24、(11分)现有下列短周期元素性质的相关数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径(10-10m) |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
1.43 |
|
最高或最低化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
–2 |
|
|
–3 |
–1 |
|
–3 |
|
试回答下列问题:
(1)上表中各元素最高价氧化物对应的水化物中,酸性最强的是(填酸的化学式)
,该元素在元素周期表中的位置是___________________。
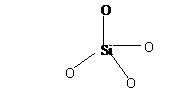
(2)周期表中,同一主族元素化学性质相似;同时有些元素和它在周期表中左上方或右下方的另一主族元素的化学性质也相似,如Li与Mg,这称为对角线规则。上表中与铍的化学性质相似的元素有(填元素名称) 。铍的最高价氧化物对应水化物属两性化合物,该化合物的化学式是 ,能够说明其具有两性的反应的离子方程式为 ;
。
(3)元素⑥的金属性比元素②要 (填“强”或“弱”),试从物质结构方面解释其原因:
。
(4)实验室现有元素②的单质和某未知金属单质M,请简要写出比较两者金属性强弱的一种实验方案 。
23、(10分)在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应:
N2O4  2 NO2 ΔH>0 ,隔一段时间对该容器内的物质进行分析,得到如下数据:
2 NO2 ΔH>0 ,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s)n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)计算20s-40s内用N2O4表示的平均反应速率为 。
(2)计算在80℃时该反应的平衡常数K 。
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有(填序号) ,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号) 。
A. 增大N2O4的起始浓度
B. 向混合气体中通入NO2
C. 使用高效催化剂
D. 升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。

20、(12分)工业制硫酸生产流程如下图:
|
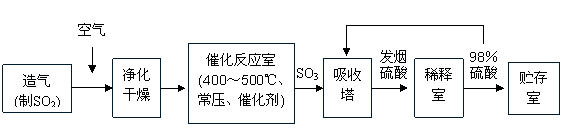

(1)在催化反应室,下列措施中有利于提高SO2平衡转化率的有
A.升高温度 B.减少压强
C.不断补充空气 D.及时分离出SO3
(2)在生产中,为提高催化剂效率采取了哪些措施?
A、净化气体 B、控制温度在400-500℃
C、增大催化剂与反应气体的接触面积 D、不断补充空气
(3)已知2SO2(g)+O2(g) 2SO3(g),ΔH=-196 kJ·mol-1。在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”“>”“=”)196kJ,理由是______________________________________________________。
2SO3(g),ΔH=-196 kJ·mol-1。在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”“>”“=”)196kJ,理由是______________________________________________________。
(4)经检测生产硫酸的原料气成分(体积分数)为SO27%、O211%、N282%。在500℃,0.1MPa条件下达到平衡时,各种气体的体积比为V(SO2):V(SO3):V(O2):V(N2)=0.46:6.5:7.7:82,则SO2的利用率为
(5)生产硫酸过程中的尾气通常用氨水吸收,请写出该反应的化学反应方程式 。

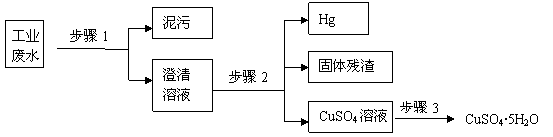
 D的化学反应方程式
。
D的化学反应方程式
。 2H2O(l);△H=-142.9kJ·mol-1
2H2O(l);△H=-142.9kJ·mol-1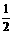 O2(g)
O2(g)  CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg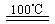 HgBr2+H2
HgBr2+H2 _____ ④2HgO
_____ ④2HgO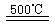 2Hg+O2↑
2Hg+O2↑ 2H2O
2H2O
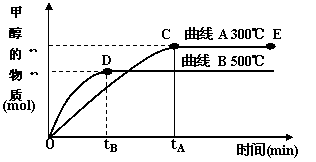
 CH3OH(g)。甲醇的物质的量与反应温度的关系如下图所示:
CH3OH(g)。甲醇的物质的量与反应温度的关系如下图所示: