0 39344 39352 39358 39362 39368 39370 39374 39380 39382 39388 39394 39398 39400 39404 39410 39412 39418 39422 39424 39428 39430 39434 39436 39438 39439 39440 39442 39443 39444 39446 39448 39452 39454 39458 39460 39464 39470 39472 39478 39482 39484 39488 39494 39500 39502 39508 39512 39514 39520 39524 39530 39538 447348
 A.用惰性电极电解饱和氯化钠溶液:
A.用惰性电极电解饱和氯化钠溶液: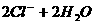
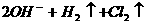
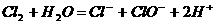
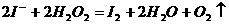
 >
> >
>
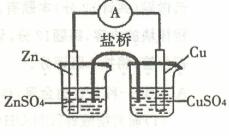 关于右图所示的原电池,下列说法正确的是
关于右图所示的原电池,下列说法正确的是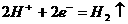
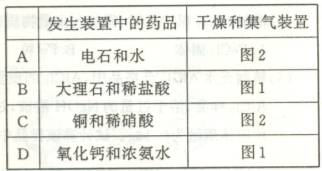
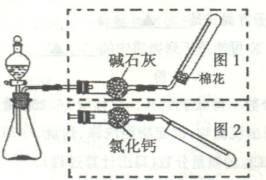
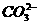 数目为0.5NA
数目为0.5NA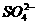
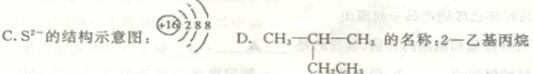
 2MnSO4+K2SO4+10CO2↑+5Na2SO4+8H2O
2MnSO4+K2SO4+10CO2↑+5Na2SO4+8H2O