18.4 g m(理论)
可得:m(理论)=2.67g,
而真实失重为:18.4 g-16.6 g=1.8 g,
m(真实)<m(理论),说明反应是按
n(NaHCO3)∶n(NaOH)<1∶1,即NaOH过量进行的,所以应以NaHCO3的量为计算依据。
|
NaHCO3 + NaOH=Na2CO3 + H2O↑ 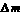
84 18
x 1.8 g
可得:x=8.4g,
混合物中NaOH的质量分数为:
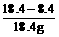 ×100%=54.3%。
×100%=54.3%。
答案:混合物中NaOH的质量分数为54.3%。
 例题2-2-5
例题2-2-5
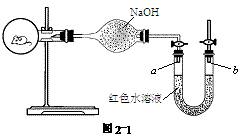
如图2-1所示,烧瓶内有一只活的小鼠,U形管内装有红色水溶液,使a,b两端的液面处于同一水平面。两天后,U形管内液面发生的变化是( )
A.a端下降,b端上升 B.a端上升,b端下降
C. a,b两端都下降 D. a,b两端都上升
 解析与答案
解析与答案
此题根据压强原理。因为小鼠吸氧呼出CO2气,且CO2又被NaOH吸收,故烧瓶内的气体越来越少,压强变小,而b端仍是一个大气压,所以a端上升,b端下降。
答案:B
 例题2-2-6
例题2-2-6
将一定量的NaOH与NaHCO3的混合物X,放在一个密闭容器中加热,充分反应后生成气体V1L(V1 0)。将反应后的固体残留物Y与过量盐酸反应,又生成CO2 V2 L。(气体体积在标准状况下测定)
0)。将反应后的固体残留物Y与过量盐酸反应,又生成CO2 V2 L。(气体体积在标准状况下测定)
(1) Y的成分是_____
A. Na2CO3和NaOH
B. Na2CO3和NaHCO3
C. Na2CO3
D. NaOH
(2) X中NaOH和NaHCO3共_____mol;
NaOH和NaHCO3物质的量之比为_____。
 解析与答案
解析与答案
本题可用列方程组求解并运用碳元素的守恒求解。
因为V1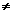 0,X受热发生反应后必无NaOH和NaHCO3剩余,X中的Na+完全转移到Na2CO3(其物质的量为
0,X受热发生反应后必无NaOH和NaHCO3剩余,X中的Na+完全转移到Na2CO3(其物质的量为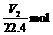 )中。则X中的Na+共
)中。则X中的Na+共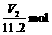 ,所以NaOH和NaHCO3共
,所以NaOH和NaHCO3共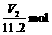 。
。
X中的碳元素全部转化为CO2,共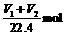 。所以X中的NaHCO3为
。所以X中的NaHCO3为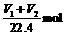 。
。
X中的NaOH为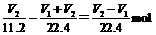 ,所以NaOH与NaHCO3物质的量之比为
,所以NaOH与NaHCO3物质的量之比为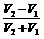 。
。
答案:(1)
C (2) X中NaOH与NaHCO3共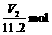 ;它们的比:
;它们的比: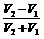 。
。
 例题2-2-7
例题2-2-7
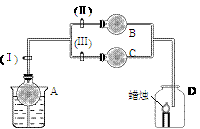
在干燥管A中为块状白色固体,B中为淡黄色粉末,C中为白色固体,并将A、B、C按如图2-2所示连接,当打开活塞(Ⅰ)(Ⅱ)时,D中蜡烛火焰明亮;打开活塞(Ⅰ)(Ⅲ)时,D中蜡烛火焰熄灭;关闭活塞(Ⅰ)时,A中反应自行停止。
试根据上述实验事实,回答以下各问题:
(1) A中发生的化学反应是_____。
(2) 在装置B中的淡黄色粉末是_____。
(3) 在干燥管C中的白色固体应为_____。
 解析与答案
解析与答案
此题以蜡烛火焰的明亮和熄灭为突破口。明亮一定是通入了O2,而熄灭一般是CO2。由此可确定B中是Na2O2(淡黄色粉末)和CO2的反应;从而可知A是产生CO2的简易启普发生器,C中是一个不与CO2反应的白色固体,即是中性或酸性的固体干燥剂。
答案: (1)CaCO3+2HCl=CaCl2+CO2↑+H2O
(2)Na2O2
(3)CaCl2或P2O5
 例题2-2-8
例题2-2-8
将70 g Na2O2和Na2O的混合物跟98 g水充分反应后,所得NaOH溶液的质量分数为50%,试分别写出Na2O2和Na2O与H2O反应的化学方程式,并计算混合物中Na2O2和Na2O的质量各是多少克?
 解析与答案
解析与答案
此题有多种解法,其中常见的可利用二元一次方程,还可利用一元一次方程法。
方法一:设混合物中Na2O2为x g,Na2O为y g
2Na2O2 + 2H2O=4NaOH + O2↑……①
2×78 4×40 32
x
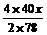
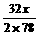
Na2O + H2O=2NaOH……②
62 2×40
y
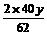
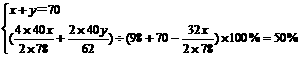
解得:x=39g,y=31g
方法二:设混合物中Na2O2为x g,则Na2O为y=(70-x)g, 同上述②反应,再列出一元一次方程:
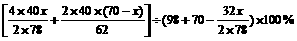 =50%
=50%
解得x=39g,所以Na2O=70-39=31g。
答案:m(Na2O2)=39g,m(Na2O)=31g
 例题2-2-9
例题2-2-9
下列关于Na2O和Na2O2的叙述正确的是( )
A.都是白色固体
B.都是碱性氧化物
C.都能和水反应形成强碱溶液
D.都是强氧化剂
 解析与答案
解析与答案
本题是考查对碱金属氧化物和过氧化物的认识。其知识核心见表。
|
组
成 |
 Na2O Na2O |
Na2O2 |
|
电 子 式 |
|
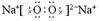 |
|
阳离子与阴离子个数比 |
2:1 |
2:1 |
|
颜色、状态 |
白色粉末 |
淡黄色粉末 |
|
氧元素价态 |
-2 |
-1 |
|
化学性质 |
碱性氧化物 |
氧化性、还原性 |
|
H2O CO2 H+ SO2 |
Na2O+H2O=2NaOH Na2O+CO2=Na2CO3 Na2O+2H+=2Na++H2O Na2O+SO2=Na2SO3 |
2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2 Na2O2+2H+=2Na++H2O2 2H2O2=2H2O+O2↑ Na2O2+SO2=Na2SO4 |
|
化学特性用途 |
无氧化性、漂白性 |
强氧化性、漂白性医用消毒水、生氧剂、漂白剂 |
通过比较可知:虽然两种氧化物的组成元素相同,但其结构、性质上的差异很大。
答案:C
 例题2-2-10
例题2-2-10
将70g过氧化钠和氧化钠的混合物跟98g水充分反应,所得氢氧化钠溶液的溶质质量分数为50%,试写出过氧化钠跟水反应的化学方程式,并计算原混合物中过氧化钠和氧化钠的质量各为多少?
 解析与答案
解析与答案
本题解题关键是对所得NaOH溶液的溶质质量分数为50%的分析,可以有两种理解:
(1) 根据溶质质量分数的概念进行计算: w(NaOH) 100%
100%
(2) 根据生成溶液中溶质和溶剂的质量相等进行计算
解:发生的反应为:Na2O+H2O=2NaOH; 2Na2O2+2H2O=4NaOH+O2↑
设混合物中含Na2O2和Na2O的质量分别为x, y
2Na2O2+2H2O=4NaOH + O2↑; Na2O + H2O=2NaOH
2 78 2
78 2 18 4
18 4 40 32 62 18 2
40 32 62 18 2 40
40
x 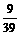 x
x 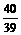 x
x 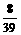 x y
x y 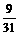 y
y 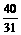 y
y
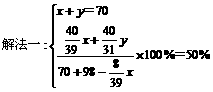
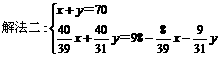
解得:x=39g;y=31g.
答案 (1)2Na2O2+2H2O=4NaOH+O2↑
(2)原混合物中含Na2O2 39g, Na2O 31g。
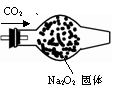
 例题2-2-11
例题2-2-11
200℃时,11.6gCO2和水蒸气的混合气体与足量的Na2O2充分反应后固体质量增加3.6g,求原混合物中CO2和H2O的质量比。
 解析与答案
解析与答案
|
|

|

 解题思路:
解题思路:
 , 本题涉及Na2O2与CO2和H2O的
, 本题涉及Na2O2与CO2和H2O的
两个反应,且两个反应中均生成O2,所以11.6g的混合气体与Na2O2反应后固体只增重了3.6g,其差量11.6g-3.6g = 8g为生成的O2的质量。
设:CO2和H2O的质量分别为x, y,则
2CO2+2Na2O2=2Na2CO3+O2,2H2O+2Na2O2=4NaOH + O2↑
2 44
32 2
44
32 2 18 32
18 32
x
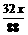 y
y
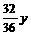

答案: 原混合物中CO2和H2O的质量比为11:18。
 例题2-2-12
例题2-2-12
CO与H2的混合气体3g,在150℃时和足量的氧气燃烧后,将所得CO2和H2O通入到足量的Na2O2后,Na2O2增重的质量为( )
A. 1.5g B. 3g C. 6g D. 无法计算
 解析与答案
解析与答案
反应过程如下
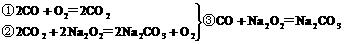
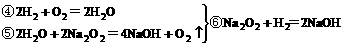
由合并的③、⑥两式看出,Na2O2增重的质量就是CO和H2的质量。
答案:B
 例题2-2-13
例题2-2-13
试列表比较Na2CO3、NaHCO3在物理、化学性质方面的异同及两者的相互转化和工业制备。
 解析与答案
解析与答案
Na2CO3、NaHCO3的比较
|
名 称 |
Na2CO3 |
NaHCO3 |
|||||||
|
俗
名 |
苏打、纯碱 |
小苏打 |
|||||||
|
物理 性质 |
颜色状态 |
白色粉末 |
细小白色晶体 |
||||||
|
水溶性 |
易溶于水 |
较易溶于水 |
|||||||
|
化学 性质 |
热稳定性 |
比较稳定 不易分解 |
2NaHCO3==Na2CO3+H2O+CO2↑ |
||||||
|
H+ |
CO32-+2H+= H2O+CO2↑ |
HCO-3+H+=H2O+CO2↑较Na2CO3快 |
|||||||
|
OH- |
与NaOH不反应 与Ca(OH)2反应生成沉淀 Na2CO3+Ca(OH)2 = CaCO3↓+2NaOH |
NaHCO3+NaOH=Na2CO3+H2O 2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O |
|||||||
|
CO2 |
Na2CO3+H2O+CO2=2NaHCO3若是饱和Na2CO3溶液,将产生NaHCO3晶体 |
不反应 |
|||||||
|
BaCl2或 CaCl2 |
CO32-+Ba2+=BaCO3↓ CO32-+Ca2+=CaCO3↓ |
不反应 |
|||||||
|
相互转化 |

|
||||||||
|
工业制备 |
2NaHCO3==Na2CO3+H2O+CO2↑ |
饱和氨盐水中通入CO2 NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl |
 例题2-2-14
例题2-2-14
今有Na2CO3、NaHCO3和NaCl的混合物100g, 加热到质量不再减少为止,剩余残渣为84.5g,将残渣溶于水,滴入足量AgNO3溶液得到白色沉淀,加足量稀HNO3后大部分沉淀消失,剩余沉淀为12.26g。试计算混合物中Na2CO3、NaHCO3和NaCl的质量分数各是多少?
 解析与答案
解析与答案
解题思路:
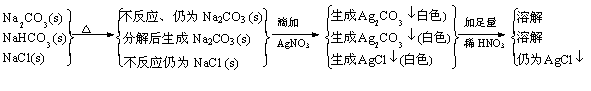
|
2NaHCO3==Na2CO3 + H2O + CO2↑ D m
2 84 18 44 62
84 18 44 62
x 100g-84.5g=15.5g
NaCl + AgNO3=AgCl↓+ NaNO3
18.4 g由NaOH和NaHCO3组成的固体混合物,在密闭容器中加热到约250℃,经充分反应后排出气
体,冷却后称得剩余固体质量为16.6 g。试计算原混合物中NaOH的质量分数。
 解析与答案
解析与答案
|
NaHCO3 + NaOH=Na2CO3 + H2O↑ ①
|
2NaHCO3=Na2CO3 + H2O↑+ CO2↑ ②
因题中并未明确NaHCO3和NaOH哪个过量,故n(NaHCO3)∶n(NaOH),应分以下三种情况讨论:
(1)n(NaHCO3)∶n(NaOH)=1∶1,
(2)n(NaHCO3)∶n(NaOH)>1∶1,
(3)n(NaHCO3)∶n(NaOH)<1∶1。
|
NaHCO3 + NaOH=Na2CO3 + H2O↑ 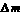
 18 18
18 18
2. 钠的化合物
钠的化合物
 例题2-2-1
例题2-2-1
将70 g过氧化钠和氧化钠的混合物跟98 g水充分反应,所得氢氧化钠溶液的溶质质量分数为
50%,试写出过氧化钠跟水反应的化学方程式,并计算原混合物中过氧化钠和氧化钠的质量各为多少?
 解析与答案
解析与答案
本题解题关键是对所得NaOH溶液的溶质质量分数50%的分析,可以有两种理解:
(1) 根据溶质质量分数的概念进行计算:
w(NaOH)= ×100%
×100%
(2) 根据所生成溶液中溶质和溶剂的质量相等进行计算.
解:发生的反应为:
Na2O+H2O=2NaOH;2Na2O2+2H2O=4NaOH+O2↑
设混合物中含Na2O2和Na2O质量分别为x,y。
2Na2O2+2H2O=4NaOH+O2↑;
2×78 2×18 4×40 32
x  x
x 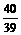 x
x 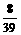 x
x
Na2O+H2O=2NaOH
62 18 2×40
y 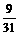 y
y 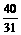 y
y
[解法一]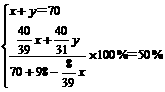
[解法二]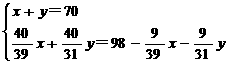
解得:x=39g; y=31g。
答案: ①2Na2O2+2H2O=4NaOH+O2↑;
②原混合物中含Na2O2 39 g,Na2O 31g。
 例题2-2-2
例题2-2-2
今有Na2CO3、NaHCO3和NaCl的混合物100g,加热到质量不再减少为止,剩余残渣为84.5g,将残渣溶于水,滴入足量AgNO3溶液得到白色沉淀,加足量稀HNO3后大部分沉淀消失,剩余沉淀为12.26g,试计算混合物中Na2CO3、NaHCO3和NaCl的质量分数各是多少?
 解析与答案
解析与答案
要计算Na2CO3、NaHCO3和NaCl的质量分数,必须求出它们在100 g混合物中各自的质量。从条件分析,这三种物质加热,只有NaHCO3受热分解,而Na2CO3、NaCl不分解,加热后剩余残渣为84.5g,减少的质量是NaHCO3加热分解跑走的CO2和H2O的质量,以此为突破口求出NaHCO3的质量;然后滴加AgNO3溶液,再加足量稀HNO3,剩余沉淀为12.26g是AgCl的质量,根据方程式再求出NaCl的质量,最后求出Na2CO3的质量。
|
2NaHCO3=Na2CO3+H2O↑+CO2↑ 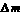
2×84 18 44 62
x 100 g-84.5 g=15.5 g
求得:x=42g。
NaCl + AgNO3=NaNO3 + AgCl↓
 例题2-3-1
例题2-3-1 。
。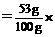 100%=53%;
100%=53%;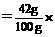 100%=42%;
100%=42%;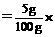 100% = 5%。
100% = 5%。 例题2-2-15
例题2-2-15 解析与答案
解析与答案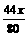 g
g 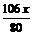 g
yg
g
yg 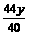 g
g 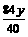 g
g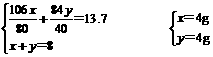
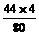 g+
g+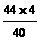 g=6.6g
g=6.6g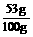 ×100%=53%,
×100%=53%,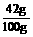 ×100%=42%,
×100%=42%, 解析与答案
解析与答案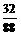 x
x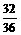 y
y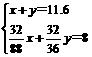
 例题2-2-4
例题2-2-4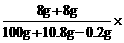 100%=14.5%
100%=14.5% 求出金属Na质量
求出金属Na质量

 生成NaOH质量
生成NaOH质量
生成NaOH质量
生成NaOH质量 
 存在: Na2O 2Na 2NaOH
存在: Na2O 2Na 2NaOH