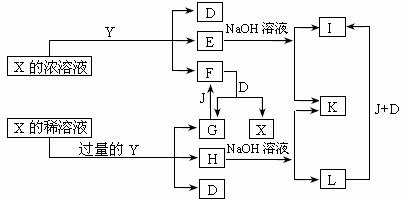
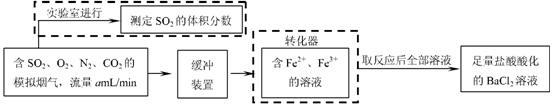
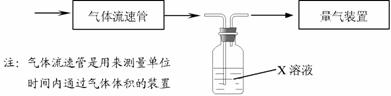
0 39349 39357 39363 39367 39373 39375 39379 39385 39387 39393 39399 39403 39405 39409 39415 39417 39423 39427 39429 39433 39435 39439 39441 39443 39444 39445 39447 39448 39449 39451 39453 39457 39459 39463 39465 39469 39475 39477 39483 39487 39489 39493 39499 39505 39507 39513 39517 39519 39525 39529 39535 39543 447348
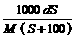 mol/L
B.
mol/L
B.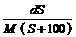 mol/L
mol/L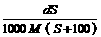 mol/L
D.
mol/L
D.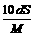 mol/L
mol/L +2H+=== I2+2H2O
+2H+=== I2+2H2O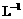 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。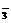 、SO
、SO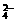 (每种离子只能用一次),现将溶液两两混合,记录现象如下:
(每种离子只能用一次),现将溶液两两混合,记录现象如下: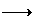 白色沉淀,A+C
白色沉淀,A+C