23、 08四川延)(14分)有一白色固体混合物,可能含有的阴、阳离子分别是
|
阳离子 |
K+ Ba2+ Ag+ Mg2+ NH4+ Na+ |
|
阴离子 |
SO42- SO32- CO32- AlO2- |
为了鉴定其中的离子,现进行如下实验,根据实验现象,填写下列表格:
(1)取该粉末,加水后得到无色溶液,且未嗅到气味;用pH试纸测得溶液的pH为12。
|
排除的离子 |
排除的依据 |
|
|
|
(2)向溶液中滴加盐酸溶液,开始有沉淀生成,继续滴加,沉淀消失,同时有无色无味气体逸出。
|
肯定存在的离子 |
判断依据 |
|
|
|
|
排除的离子 |
排除的依据 |
|
|
|
(3)尚待检验的离子及其检验方法
|
尚待检验的离子 |
检验方法 |
|
|
|
(1)
|
排除的离子 |
排除的依据 |
|
NH4+ Ag+、Mg2+ |
由于溶液呈碱性,且未嗅到刺激性气味 碱性溶液中无沉淀生成 |
(2)
|
肯定存在的离子 |
判断依据 |
|
AlO2- CO32- |
加酸有沉淀,继续加酸沉淀溶解 加酸后有无色无味气体逸出 |
|
排除的离子 |
排除的依据 |
|
Ba2+
SO32- |
有CO32- 存在时原溶液无沉淀 酸化后逸出的气体没有刺激性气味 |
(3)
|
尚待检验的离子 |
检验方法 |
|
K+、 Na+ SO42- |
焰色反应 酸溶液中滴加BaCl2溶液,是否有白色沉淀生成 |
24.(7分)短周期元素的A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等。据此填空:
|
A |
|
C |
|
|
B |
|
(1)A的氢化物分子式为 ;
(2)B的元素符号为 ,原子结构示意图为 ,在周期表中位于第 周期 族;
(3)C的单质分子式为 ,C的单质溶于水所得溶液叫 。
 2NO ②
③
④
2NO ②
③
④
 A ________________________;A→C __________________________;
A ________________________;A→C __________________________;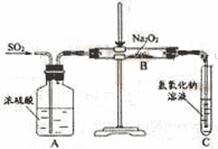

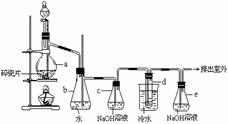 填写下列空白:
填写下列空白: