|
|
NaOH溶液起始读数 |
NaOH溶液终点读数 |
|
第一次 |
0.01mL |
18.60mL |
|
第二次 |
0.20mL |
18.70mL |
(1)根据以上数据可计算出盐酸的物质的量浓度为 mol/L。(精确到0.01)
(2)如标准NaOH溶液由于保存不妥而变质(和空气中CO2反应产生少量Na2CO3)测出的盐酸浓度
(填“偏高”、“偏低”或不变”)。
(3)若操作有误,则导致待测盐酸溶液浓度偏低的错误操作是 (填序号)。
A.滴定管用蒸馏水洗后未用标准碱液润洗,直接装入标准碱液
B.滴定前滴定管尖端有气泡,滴后气泡消失 C.滴定管读数时,滴定前仰视滴定后俯视
D.待测液中指示剂酚酞(为有机弱酸)加得太多
(4)如果准确移取25.00mL 0.20mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度? (填 “是”或“否”)
20、 (12分)(往届)已知A、B、D、E四种物质中含有同一种短周期元素,D为气体单质,E为黑色粉末,在右图的转化中E均起催化作用(某些产物已略去)。
(12分)(往届)已知A、B、D、E四种物质中含有同一种短周期元素,D为气体单质,E为黑色粉末,在右图的转化中E均起催化作用(某些产物已略去)。
请回答:
(1)A的化学式: ;
B分子的电子式: 。
(2)已知E与含A中某元素的酸在一定条件下反应,产生一种含该元素的气体X。
我校某班化学兴趣小组为研究该气体的性质,设计下图所示的装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
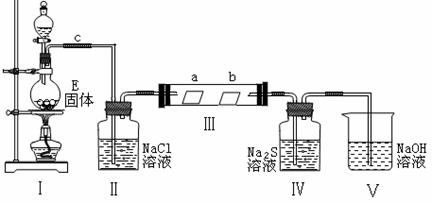
①写出装置Ⅰ中发生反应的离子方程式: 。
②实验过程中,观察到装置Ⅳ中出现淡黄色沉淀,其主要反应的离子方程式: 。
③实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是a出现了明显的变化。你认为在装置(选填装置序号) 之间,还需添加洗气瓶,该装置的作用是: 。
(3)气体X能与溶液B反应,生成气体D,写出反应的化学方程式: 。
16. 在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,
溶液立即变蓝,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失。
下列判断不正确的是
A.氧化性:ClO –>I2>SO42–
B.漂白粉溶液可使淀粉碘化钾试纸变蓝
C.向氯水中加入亚硫酸钠溶液,氯水褪色
D.次氯酸钠可以与亚硫酸钠共存
|
 xC(g)+2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,通过计算完成下列问题:
xC(g)+2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,通过计算完成下列问题:
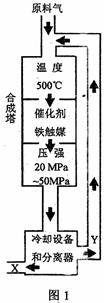 图1所示。
图1所示。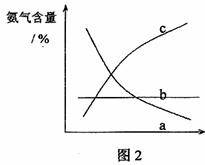
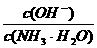 的值 (填“增大”
的值 (填“增大”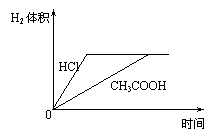 对室温下100mLpH=2的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
对室温下100mLpH=2的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是 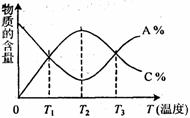
 已知可逆反应aA+bB cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )
已知可逆反应aA+bB cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )