18.(8分)(1)多硫离子Sx2-(x是2-6整数)碱性溶液中被BrO3-氧化成SO42-,BrO3-自身被还原成Br-,该反应的离子方程式是
3Sx2-+6(x-1)OH-+(3x+1)BrO3- 3xSO42-+(3x+1)Br-+3(x-1)H2O
该反应中Sx2-作还原剂。每1mol Sx2-失去 mol电子。若通过测定BrO3-与OH-的用量情况来确定x的值,至少需要确定以下A-C中的 才能确定Sx2-中的x的值.
A.BrO3-或OH-的绝对用量 B.BrO3-与OH-的绝对用量
|
 (2)多硫化钠是一种重要的多硫化物,利用反应2Na+xS
Na2Sx在一定条件下制成的钠硫可逆电池是目前推广使用的一种新型高能电池,该电池工作时的正极反应是
,给该电池充电时,钠极反应与外电源的
极相连接。
(2)多硫化钠是一种重要的多硫化物,利用反应2Na+xS
Na2Sx在一定条件下制成的钠硫可逆电池是目前推广使用的一种新型高能电池,该电池工作时的正极反应是
,给该电池充电时,钠极反应与外电源的
极相连接。
 pC(g)+qD(g);△H<0。下列结论中正确的是
pC(g)+qD(g);△H<0。下列结论中正确的是 
 Al(OH)3↓
Al(OH)3↓ 酸性弱,
酸性弱,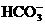 比HBrO难电离,则下列反应不能发生的是( )
比HBrO难电离,则下列反应不能发生的是( )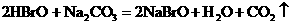
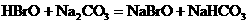
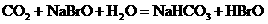
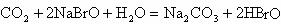
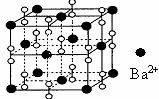 A.该晶体属于离子晶体
A.该晶体属于离子晶体