20.(11分)铁合金是金属材料王国的霸主,亚铁盐、铁盐等铁的重要化合物也在不同领域中扮演着重要的角色。这些化合物之间可以相互转化,利用转化过程中发生的特征变化,不仅能够实现物质或能量的转化,还用于化学的定性或定量研究。
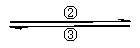
 0
+2
+3
0
+2
+3
Fe Fe Fe
(1)写出实现上述各步转化的化学方程式(是离子反应的,只写离子方程式):
① ; ② ;
③ ; ④ 。
(2)FeCl3可用作印刷电路铜板腐蚀剂。用FeCl3溶液腐蚀印刷电路铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
|
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
19.(10分)氧族元素的各种性质可归纳整理出如下(部分):
|
元素 性质 |
8O |
16S |
Se |
52Te |
|
单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
|
主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
|
原子半径(nm) |
0.074 |
0.102 |
0.116 |
0.143 |
|
单质与H2反应 |
点热易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
回答下列问题:
|
(2)H2O2可以作脱氯剂,用于消除水中的Cl2,写出该反应的化学方程式:
。
 (3)碲的主要化合价可能有
。
(3)碲的主要化合价可能有
。
(4)工业上可用Al2Te3制备H2Te,化学方程式为:
。
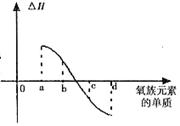
(5)右图所示为上述氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族中某一元素的单质,△H为相同物质的量的单质与H2反应过程中的能量变化(反应的热效应)。则:b代表 ,d代表 (写化学式)。
(四)请你参与以下探究
(1)实验A反应速度明显比B小,原因是 。
(2)根据“铜位于金属活动顺序表氢之后,与稀盐酸不反应,而在实验C中加热时又产生气体”的事实,作出如下推断:
①有同学认为“实验C中加热时产生的气体是溶解在溶液中的H2”,你认为是否有道理,理由是 。
②某同学作了如下猜想:是否成立?请你设计实验方案加以验证。
|
猜想 |
验证方法 |
预测现象及结论 |
|
认为铜片中可能含有锌等杂质 |
|
|
(3)某同学对实验D中的白色沉淀进行分析:“不可能是CuCl2,因为CuCl2能溶于水且溶液显蓝色;也不可能是ZnCl2,因为稀释后溶液更稀,不会析出ZnCl2晶体。若利用资料卡片资料①②大胆猜想,白色沉淀可能是CuCl。请你帮他设计验证方案。
|
猜想 |
预设验证方法 |
猜想的现象与结论 |
|
白色沉淀 是氯化亚铜 |
|
|
(4)指导老师肯定了实验D中的白色沉淀是CuCl;并指出生成沉淀的原因,实际上是[CuCl4]3-等离子与CuCl(s)、Cl-三者之间所形成的沉淀溶解平衡移动的结果。请写出这一平衡关系式(用离子方程式表示) 。
(三)背景资料
|
资料卡片 主题:生成一价铜的反应  ① 必修一,P116:4CuO === 2Cu2O + O2↑ ① 必修一,P116:4CuO === 2Cu2O + O2↑②《无机化学》下册,p705:2Cu2+ + 4I- == 2CuI(白色)↓+ I2 ③《无机化学》下册,p706:氯化亚铜(CuCl)在不同浓度的KCl溶液中可形成[CuCl4]3+等无色离子。 |
(二) 实验记录:
|
交流卡片 主题:Zn、Cu与浓盐酸间的实验 A.将锌放入浓盐酸的实验 B.将锌与铜片贴在一起,一同放入浓盐酸中,反应快速放出气体 C.当实验B中锌片完全溶解后,将溶液加热,又产生大量气体,得到无色溶液 D.将实验C反应后的溶液隔绝空气,加入适量水,出现白色沉淀 |
16.把一定量的Na2O2和NaHCO3混合粉末分为两等份,将其中一份加入到100mL稀盐酸中恰好完全反应,生成干燥的气体2.24L(标准状况),再将此气体通入到另一份混合物中,充分反应后,气体减少为2.016L(标准状况),则原混合粉末中Na2O2和NaHCO3的物质的量之比及原稀盐酸的物质的量浓度可能是( )
|
|
A |
B |
C |
D |
|
Na2O2和NaHCO3的 物质的量之比 |
8﹕1 |
9﹕2 |
1﹕8 |
2﹕9 |
|
原稀盐酸的 物质的量浓度(mol/L) |
3.4 |
1.1 |
1.8 |
1.3 |
第Ⅱ卷(非选择题,共64分)
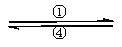
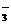 ,煮沸去掉过量的Br2;
,煮沸去掉过量的Br2; (1)写出步骤②的离子方程式,并标出下列反应的电子转移的方向和数目:
(1)写出步骤②的离子方程式,并标出下列反应的电子转移的方向和数目: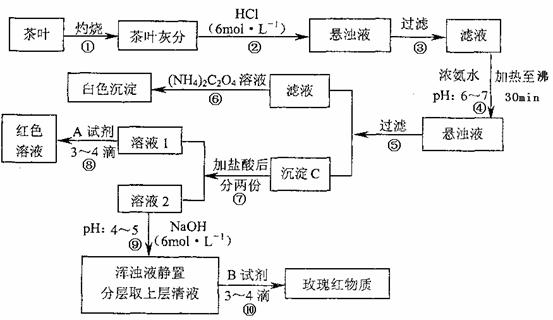
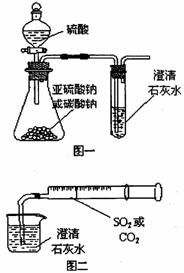 (8分)某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象。经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓缓地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象。回答下列问题:
(8分)某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象。经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓缓地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象。回答下列问题: