27.(8分)元素周期表反映了元素性质的周期性变化规律。请根据短周期元素
|
氢化物 |
沸点/℃ |
|
A |
1317 |
|
B |
100 |
|
C |
19.5 |
|
D |
-33 |
|
E |
-162 |
在周期表中的位置、结构和相关性质,回答下列问题:
⑴ 短周期元素中,原子最外层电子数的1/2和电子层数相等的元素有 (写元素符号)。
⑵ 第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如右表1所示,其中D的化学式为 ;第三周期元素单质的熔点(℃)变化如下图I 所示,其中h和b的元素符号为 。
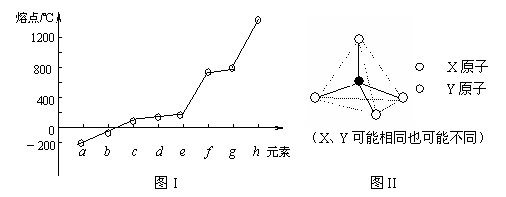 ⑶ 原子半径最小的元素与第二周期的两种元素可分别形成分子甲和离子乙。分子甲含10个电子、3个原子,它与离子乙含有相等的电子数;且乙的立体结构如图II所示。请写出甲、乙反应的离子方程式
。
⑶ 原子半径最小的元素与第二周期的两种元素可分别形成分子甲和离子乙。分子甲含10个电子、3个原子,它与离子乙含有相等的电子数;且乙的立体结构如图II所示。请写出甲、乙反应的离子方程式
。
⑷ 第二、第三周期的某些元素中能形成具有图II所示的结构单元的单质和化合物:
其中熔点最高单质的名称是 ;同周期元素形成这种结构单元的化合物的化学式为: 。
24.(12分) 铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应 ,负极反应 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
|
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式 、
劣质不锈钢腐蚀的实验现象: 25.(11分)I.高炉炼铁中发生的基本反应之一是FeO(s)+CO(g)⇋Fe(s)+CO2(g) ΔH>0。其平衡常数可表达为k =c(CO2)/c(CO),已知1100℃时,k=0.263。
(1)温度升高,平衡移动后达到新的平衡,高炉内CO2和CO的体积比值 (填“增大”“减小”或“不变”),平衡常数k值 (填“增大”“减小”或“不变”)。
 (2)1100℃时测得高炉中c(CO2)=0.025mol∙L-1,c(CO)=0.1mol∙L-1,在这种情况下,该反应是否处于平衡状态 (填“是”或“否”)。此时,化学反应速率是v(正) v(逆)(填“>”“<”或“=”),原
(2)1100℃时测得高炉中c(CO2)=0.025mol∙L-1,c(CO)=0.1mol∙L-1,在这种情况下,该反应是否处于平衡状态 (填“是”或“否”)。此时,化学反应速率是v(正) v(逆)(填“>”“<”或“=”),原
因是
II.如图所示,温度不变时,把某容器分割成A、B两部分,A容器体积固定不变,B有可移动的活塞,现在A中充入2 mol SO2和1 mol O2,在B中充入2 mol SO3和 1 mol N2,在相同条件下发生可逆反应:2 SO2(g)+O2(g)  2 SO3(g)。根据下列要求填写空白:
2 SO3(g)。根据下列要求填写空白:
(1)固定活塞位置在3处不动,达到平衡时,设A中压强为PA , B中压强为PB,则PA与PB的关系是PA _____ PB(填“<”、“=”、“>”)。
(2)若要使A与B中平衡状态相同,可移动活塞的位置应在 处。
(3)若活塞右移到5处,达到平衡后,B中SO3为x mol,
A中SO3为y mol , 则x和y 的关系是x y. (填“<”、“=”、“>”)
22. (9分) 学习了元素周期律后,同学们对第四周期过渡元素氧化物产生了浓厚的兴趣。是否只有二氧化锰能催化氯酸钾受热分解?氧化铁、氧化铜、氧化铬等对氯酸钾的受热分解有没有催化作用?对此他们进行了实验探究。请你根据要求完成下列部分实验报告。
I 课题名称:____________________________________________________________
II实验仪器及试剂:实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、大试管、酒精灯、计时器(或秒表)等。
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
III 实验步骤:略
IV 实验数据:
|
实验 编号 |
KClO3(g) |
氧化物 |
产生气体(mL) |
耗时(s) |
||
|
化学式 |
质量(g) |
回收 |
(已折算为标况) |
|||
|
1 |
0.60 |
- |
- |
- |
10 |
480 |
|
2 |
0.60 |
MnO2 |
0.20 |
90% |
67.2 |
36.5 |
|
3 |
0.60 |
CuO |
0.20 |
90% |
67.2 |
79.5 |
|
4 |
0.60 |
Fe2O3 |
0.20 |
90% |
67.2 |
34.7 |
|
5 |
0.60 |
Cr2O3 |
0.20 |
异常 |
67.2 |
188.3 |
V 实验讨论:(1)实验编号3的实验中KClO3的分解率为_________%(保留一位小数)
(2) 在用Cr2O3 做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色。该刺激性气体是________(填分子式),可用______________试纸检验。上述异常现象产生的原因是____________ _______________________。
VI 实验结论:_____________________________________________________________
21.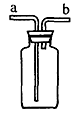 (6分)如图所示装置是化学实验中常用的仪器,可用于气体收集和除杂等。请根据实验目的完成下表(可以不填满):
(6分)如图所示装置是化学实验中常用的仪器,可用于气体收集和除杂等。请根据实验目的完成下表(可以不填满):
|
实验目的 |
瓶中加入的试剂 |
气体入口(填a或b) |
|
收集NO |
|
|
|
收集SO2 |
|
|
|
除去HBr中的Br2 |
|
|
18.实验测得气态无水氯化铝在1.01×105Pa、不同温度(t3>t2>t1)时的密度(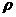 )和气体摩尔体积(Vm)为
)和气体摩尔体积(Vm)为
|
t/℃ |
t1 |
t2 |
t3 |
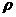 /g·L-1 /g·L-1 |
5.00 |
2.67 |
1.48 |
|
Vm/L·mol-1 |
53.4 |
70.0 |
90.0 |
可见,t2℃时无水氯化铝存在形式的化学式为
|
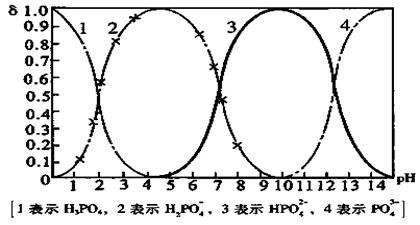
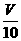 mL,用c/ mol/L NaOH溶液滴定,恰好用去V′mL。
mL,用c/ mol/L NaOH溶液滴定,恰好用去V′mL。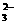 +O2+xOH-
+O2+xOH-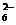 +2H2O下列说法中,正确的是
+2H2O下列说法中,正确的是  ①C2H2(g)+H2(g) C2H4(g)
①C2H2(g)+H2(g) C2H4(g)  ②CH4(g) H2(g)+
②CH4(g) H2(g)+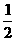 C2H4(g)
C2H4(g) 1LpH = 2的盐酸和醋酸溶液中,分别投入0.65g锌粒,则下图比较符合客观事实的是:
1LpH = 2的盐酸和醋酸溶液中,分别投入0.65g锌粒,则下图比较符合客观事实的是: