26.(10分)亚硝酰氯(C1NO)是有机合成中的重要试剂,可由NO与C12在通常条件下反应得到。某研究性学习小组拟在通风橱中制取亚硝酰氯,先查得其如下资料:
|
英文名称 |
nitrosylchloride nitrogenoxychloride |
别名 |
氯化亚硝酰;氧氯化氮 |
||||
|
分子式 |
C1NO |
外观与性状 |
红褐色液体或黄色气体,具有刺鼻恶臭味,遇水或潮气分解成氮的氧化物和 氯化氢。 |
||||
|
熔点 |
-64.5℃ |
沸点 |
-5.5℃ |
溶解性 |
溶于浓硫酸 |
||
|
危险标记 |
有毒气体,有机剧毒品 |
主要用途 |
用于合成清洁剂、触媒 及中间体 |
||||
之后他们拟定了如下合成装置示意图:
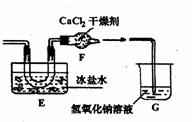
|
|
|
|



试回答下列问题:
(1)实验室制备 C12选用的装置是 (选填:甲、乙、丙),
(2) 无水氯化钙的作用是: 。
(3) 写出亚硝酰氯水解的化学方程式: 。
(4) E装置中为什么选用冰盐水而不用冰水
(5)指导老师认为装置G不能有效除去有毒气体,为什么?如何改进尾气的吸收装置(画出装置图及必要的文字说明)。
。
23.(11分)某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
|
物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
- |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答: (填“合理”或“不合理”)
(2)若设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是 ,反应的离子方程式为 。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是 (填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
 (1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为 。
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为 。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为 ;
上述现象说明溶液中____________结合OH-的能力比 强(填离子符号)。
(3)B与A的差值为 mol。
 (1)凡与醛基直接相连的碳原子上的氢称为α-H原子,在稀碱溶液的催化作用下,一个醛分子上的α-H原子连接到另一个醛分子中醛基的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:
(1)凡与醛基直接相连的碳原子上的氢称为α-H原子,在稀碱溶液的催化作用下,一个醛分子上的α-H原子连接到另一个醛分子中醛基的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如: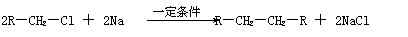 (2)
(2)


 (10分)新型节能材料高温超导体的最先突破是在1987年从新的钇钡铜氧材料的研究开始的。在制备钇钡铜氧高温超导体的同时,偶然得到了副产品--紫色的硅酸铜钡。凑巧的是,后者正是发现于中汗代器物上的被称为“汗紫”的颜料,还发现于秦俑彩绘。
(10分)新型节能材料高温超导体的最先突破是在1987年从新的钇钡铜氧材料的研究开始的。在制备钇钡铜氧高温超导体的同时,偶然得到了副产品--紫色的硅酸铜钡。凑巧的是,后者正是发现于中汗代器物上的被称为“汗紫”的颜料,还发现于秦俑彩绘。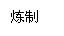
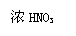
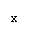
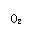




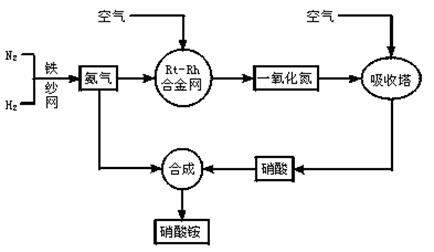
 ①
;
①
;
 2NH3(g) ΔH=-92.4kJ·mol-1。请回答:
2NH3(g) ΔH=-92.4kJ·mol-1。请回答: (2)用惰性电极电解NaCl与NaHCO3混合溶液,测得溶液pH变化如下图所示。
(2)用惰性电极电解NaCl与NaHCO3混合溶液,测得溶液pH变化如下图所示。