24.(9分)在标准状况下,取甲、乙、丙各30mL相同浓度的盐酸然后分别慢慢加入组成相同的镁铝合金粉末,得到下表中有关数据(本题中假设反应前后溶液体积不发生变化),请回答:
|
实验序号 |
甲 |
乙 |
丙 |
|
合金质量/mg |
255 |
385 |
459 |
|
气体体积/mL |
280 |
336 |
336 |
(1)甲组实验中,盐酸(选填“过量”、“适量”、“足量、不足量”,下同) ;乙组实验中盐酸 。
(2)盐酸的物质的量浓度为 。
(3)合金中镁铝的物质的量之比为 。
(4)丙实验之后,向容器中加入一定量的1.00mol/LNaOH溶液,能使合金中的铝粉恰好溶解,再过滤出不溶性固体,则所得滤液中各溶质的物质的量浓度为 。
23.(5分)下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ)
|
物质 |
Cl2 |
Br2 |
I2 |
HCl |
HBr |
HI |
H2 |
|
能量/kJ |
243 |
193 |
151 |
432 |
366 |
298 |
436 |
根据上述数据回答(1)-(3)题。
⑴下列氢化物中最稳定的是 ;
A.HCI B.HBr C.HI D.HF
⑵X2+H2=2HX(X代表Cl、Br、I)的反应是 (填“吸热”或“放热”)反应;
⑶相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是 ;
⑷写出氢气在氯气中燃烧生成氯化氢气体的热化学方程式:
。
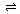 pC(g)+qD(g);△H<0。下列结论中正确的是
pC(g)+qD(g);△H<0。下列结论中正确的是 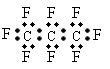 最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”-全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是( )
最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”-全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是( )