28.2005年诺贝尔化学奖授予了三位科学家,以表彰他们在烯烃复分解反应研究方面所取得的成绩。已知烯烃的交叉复分解反应机理为双键断裂,换位连接。如:
CH2=CHR1+CH2=CHR2 CH2=CH2+R1CH=CHR2
CH2=CH2+R1CH=CHR2
|
 又已知:①R-CH2-CH=CH2+Cl2
R-CHCl–CH=CH2+HCl
又已知:①R-CH2-CH=CH2+Cl2
R-CHCl–CH=CH2+HCl
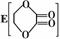
②F是油脂水解产物之一,能与水任意比互溶;K是一种塑料;I的分子式为C9H14O6
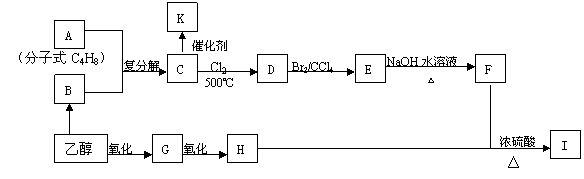

请回答下列问题:
(1)C4H8属于烯烃的同分异构体有 种;
(2)分子式为C4H8的所有烯烃通过烯烃复分解反应后生成的C5H10有 种结构
(3)请写出物质I的结构简式: ;
(4)写出下列反应方程式:C→D:
(5)K中的链节是 ;K属于 (线型、体型)结构
24.(12分)某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
|
实验步骤 |
实验现象 |
|
将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
|
反应结束后分离出溶液备用 |
|
|
红色固体用蒸馏水洗涤后,置于潮湿空气中 |
一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应:____________________________________;
化合反应:____________________________________。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是_________________________________________。解释此现象的离子方程式是_____________________________________
_________________________________________。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰。
①用铝与软锰矿冶炼锰的原理是(用化学方程式表示)________________________________________________。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是______________________________________。
23.(13分)某学校化学兴趣小组同学在两支小试管中分别加入浓度为4mol/L稀盐酸3mL,将分别装有0.3gNaHCO3和0.3gNa2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3和Na2CO3同时倒人试管中,观察到的现象及分析如下:
(1)比较两支试管中的现象: 。
(2)若两气球内的压强相同.两试管大小相同,则大小气球体积之比约为 (填最简整数比)
(3)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。甲同学写出了下列热化学方程式(其中“aq”代表水合或无限稀释的含义):
HCO3-(aq)+H+(aq)=H2O(1)+CO2(g);△H>O;
CO32-(aq)+2H+(aq)=H2O(1)+CO2(g);△H<O;
甲分析结论的方法是否科学? 。(填“是”或“否”)
|
序 号 |
试剂l |
试剂2 |
混合前温度 |
混合后最高或最低温度 |
|
1 |
35mL水 |
2.5gNaHCO3固体 |
20℃ |
18.5℃ |
|
2 |
35mL水 |
3.2gNa2CO3固体 |
20℃ |
24.3℃ |
|
3 |
35mL稀盐酸 |
含2.5g NaHCO3 的饱和溶液32.5ml |
20℃ |
19℃ |
|
4 |
35mL稀盐酸 |
含3.2g Na2CO3的饱和溶23.1mL+10mL水 |
20℃ |
24.2℃ |
|
5 |
35mL稀盐酸 |
2.5g NaHCO3固体 |
20℃ |
16.2℃ |
|
6 |
35mL稀盐酸 |
3.2gNa2CO3固体 |
20℃ |
25.1℃ |
(4)为研究反应是吸热还是放热,乙同学继续进行下列实验。(每个实验平行做三次,取平均值)
请你帮助填写相关内容:
①该研究报告的题目是《 》
②通过上述实验可得出五条结论:
a.NaHCO3的溶解是 (“吸热”或“放热”)过程;
b.Na2CO3的溶解是 (“吸热”或“放热”)过程;
c.NaHCO3的饱和溶液和盐酸的反应是 (”吸热”或“放热”)反应;
d.Na2CO3的饱和溶液和盐酸的反应是 (“吸热”或“放热”)反应;
e.NaHCO3固体与稀盐酸反应的反应热是 (填a→d的字母)的热效应之和。
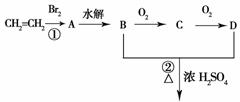
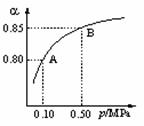 (1)硫酸生产中,SO2催化氧化生成SO3: 2SO2(g)+O2(g)
(1)硫酸生产中,SO2催化氧化生成SO3: 2SO2(g)+O2(g)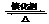 2SO3(g)。某温度下,SO2的平衡转化率(a )与体系总压强(p)的关系如图所示。根据图示回答下列问题:
2SO3(g)。某温度下,SO2的平衡转化率(a )与体系总压强(p)的关系如图所示。根据图示回答下列问题:
 ①高温下用碳还原二氧化硅制得粗硅
①高温下用碳还原二氧化硅制得粗硅
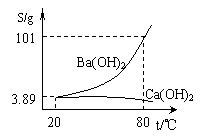 (6分)实验室有一份混有少量碳酸钙杂质的碳酸钡样品。分离并提纯碳酸钡的实验步骤如下,请根据要求填空(下图为Ba(OH)2和Ca(OH)2的溶解度曲线):
(6分)实验室有一份混有少量碳酸钙杂质的碳酸钡样品。分离并提纯碳酸钡的实验步骤如下,请根据要求填空(下图为Ba(OH)2和Ca(OH)2的溶解度曲线):