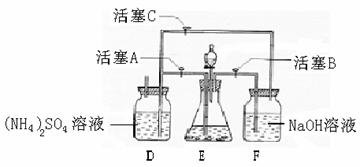
24 (9分)[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂。某研究性学习小组设计了下面的实验装置来制备[(NH4)2SO4·FeSO4·6H2O]。 实验步骤:
(1)把30%NaOH溶液和废铁屑混合、煮沸、冷却,将洗涤铁屑后的NaOH溶液装入F中。
(2)在E中用处理过的Fe屑和稀H2SO4反应制取FeSO4。
(3)将硫酸亚铁溶液与硫酸铵溶液混合,结晶得[(NH4)2SO4·FeSO4·6H2O]。
试回答下列问题:
(1)用Fe屑和稀H2SO4反应产生的氢气赶走装置中的氧气及(NH4)2SO4溶液中的溶解氧,其目的是 ;操作时应先关闭活塞 ,并同时打开活塞 ;
请写出Fe屑和稀H2SO4反应产生的氢气的另外一个作用 。
(2)使[(NH4)2SO4·FeSO4·6H2O]结晶的实验操作是:将硫酸亚铁溶液与硫酸铵溶液的混合液转移至蒸发皿中, ,得到[(NH4)2SO4·FeSO4·6H2O]晶体。
(3)原料利用率高,副产品少,产生的有害废物少,保护环境是“绿色化学”的主要内涵。请写出此实验中能体现“绿色化学”的具体做法(至少写出两点):
、 。
25 (11分)某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
|
物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
-- |
Ⅰ.(1) 该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_________________(填“合理”或“不合理”)。
(2) 设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_______,反应的离子方程式为______________________________。
(3) 实验室溶解该熔融物,下列试剂中最好的是____________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ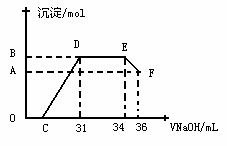 . 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
. 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
(1) 图中OC段没有沉淀生成,此阶段发生反应的离子方程式为__________ _____。
(2) 在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为____ __;
上述现象说明溶液中 、 、_______结合OH-的能力比________强(填离子符号)。
(3) B与A的差值为_________mol。
26 (12分)新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)HClO不稳定,见光易分解生成HCl和O2。请设计实验证明有O2生成 _________________________________ 。
(2)氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请你设计实验,得出正确结论。
|
提出问题 |
收集资料 |
提出假设 |
验证假设 |
得出结论 |
|
氯水中何种物质能使湿润的红色布条褪色? |
①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 |
①_____________ ____________。 ②_____________ ____________。 ③____________ _____________。 ④ H2O使布条褪色 |
实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色; 实验②:_______________。 实验③:把红色布条放在水里,布条不褪色。 |
________ _________ |
(3)平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。
H2CO3  HCO3- + H+ Ka1(H2CO3)
= c(HCO3-)·c(H+)/c(H2CO3)
= 4.45×10-7
HCO3- + H+ Ka1(H2CO3)
= c(HCO3-)·c(H+)/c(H2CO3)
= 4.45×10-7
HCO3- CO32- + H+ Ka2(H2CO3)
= c(CO32-) ·c(H+)/ c(HCO3-) = 5.61×10-11
CO32- + H+ Ka2(H2CO3)
= c(CO32-) ·c(H+)/ c(HCO3-) = 5.61×10-11
HClO  H+ + ClO- Ka(HClO) = 2.95×10-8
H+ + ClO- Ka(HClO) = 2.95×10-8
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
①将少量的氯气通入到过量的碳酸钠溶液中____________________________________;
②氯气和碳酸钠按照1︰1的比例恰好反应_____________________________________;
③将过量的氯气通入到少量的碳酸钠溶液______________________________________。
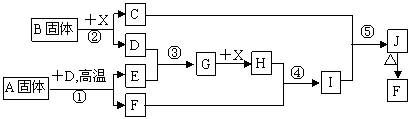
 21 (8分)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物。它们之间有如下转化关系:
21 (8分)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物。它们之间有如下转化关系: 2C(g)+Q(Q>0)进行至t时刻,发现C的百分含量仍在增大,此时要增大正反应的速率,可采取的措施是( )
2C(g)+Q(Q>0)进行至t时刻,发现C的百分含量仍在增大,此时要增大正反应的速率,可采取的措施是( )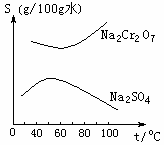 根据右图所示的溶解度表,要从混有Na2SO4的Na2Cr2O7晶体中得到Na2Cr2O7,需要进行三个操作。
根据右图所示的溶解度表,要从混有Na2SO4的Na2Cr2O7晶体中得到Na2Cr2O7,需要进行三个操作。