24(8分)工业上可利用反应:CH4(g)+H2O(g) CO(g)+3H2(g) ,生产合成氨原料气H2。
CO(g)+3H2(g) ,生产合成氨原料气H2。
已知温度、压强和水碳比[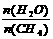 ]对甲烷蒸气转化反应的影响如下图:
]对甲烷蒸气转化反应的影响如下图:
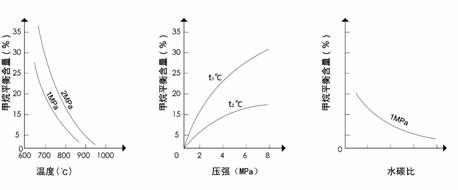
图1(水碳比为3) 图2(水碳比为3) 图3(800℃)
该反应平衡常数表达式为K=__________
(1)升高温度,平衡常数K__________(选填“增大”、“减小”或“不变”,下同)。
(2)图2中,两条曲线所示温度的关系是:t1_____t2(选填>、=或<);在图3中画出压强为2 MPa时,CH4平衡含量与水碳比之间关系曲线。
(3)工业生产中使用镍作催化剂。但要求原料中含硫量小于5×10-7%,其目的是__________
25(13分)常温下甲醛是一种无色、有特殊刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确定的致癌物和致畸形物之一。我国规定:居室空气中甲醛的最高允许浓度为0.08mg/m3。某研究性学习小组设计用如下方法测定某居室空气中甲醛的含量(假设空气中无其它还原性气体):
⑴ 测定原理: KMnO4(H+)溶液为强氧化剂,可氧化甲醛和草酸,
化学反应离子方程式为: 4MnO4-+ 5HCHO + 12H+ == 4Mn2+ + 5CO2↑+ 11H2O
2MnO4-+
 5H2C2O4
+ 6H+ == 2Mn2++10CO2↑+ 8H2O
5H2C2O4
+ 6H+ == 2Mn2++10CO2↑+ 8H2O
|
|
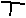
|
|
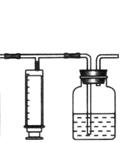
⑶ 实验步骤:
① 检查装置气密性(气密性良好)。
② 用 (填仪器名称)准确移取25.00 mL 1.00×10-3mol·L-1的高锰酸钾溶液(过量)于广口瓶中并滴入3滴6mol·L-1H2SO4溶液备用。
③ 将2.00×10-3mol·L-1的草酸标准溶液置于 (填仪器名称)中备用。
④ 打开a,关闭b,用注射器抽取100mL新装修的室内空气。关闭a,打开b,再缓缓推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再如此重复4次(共5次)。如果压送气体时速度过快,可能会产生什么不利后果?
_________________________________________________________;
⑤ 将广口瓶中的溶液转入锥形瓶中(润洗广口瓶2-3次,并将洗涤液全部转入锥形瓶)。如果没有润洗,所测甲醛的含量将 (填“偏高”、“偏低”、“无影响”);
⑥ 用标准草酸溶液滴定锥形瓶中的溶液;记录滴定所消耗的草酸溶液体积。
本实验是否需要指示剂?(如果需要,请写出指示剂的名称;如果不需要,试说明终点时的实验现象)。 。
⑦ 再重复实验2次。
⑷ 数据处理:分别于装修完工后的第1天、第7天、第30天(室内始终保持通风换气状况)对室内空气进行取样,通过实验测得以下三组数据(每次实验所取的KMnO4溶液均为 25.00mL):
|
装修后 第n天 |
草酸溶液(mL) |
甲醛的浓度 mg/m3 |
|||
|
1 |
2 |
3 |
平均值 |
||
|
1 |
15.86 |
15.72 |
15.67 |
15.75 |
|
|
7 |
26.17 |
26.36 |
26.38 |
26.27 |
|
|
30 |
30.90 |
30.67 |
30.81 |
30.79 |
|
设KMnO4溶液的物质的量浓度为c1,KMnO4溶液的体积为V1(mL);
草酸溶液的物质的量浓度为c2,草酸溶液的平均体积为V2(mL)
则:计算室内空气中甲醛浓度(mg/m3)的代数式为 ,计算第30天室内空气中甲醛浓度为_____________(精确到小数点后二位),并判断此时主人________(填“能”或“否”)入住。
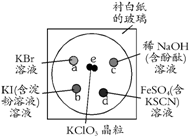 21(10分)为了减少污染,使实验绿色化,学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如右图所示),在圆心处放置2粒芝麻大小的KClO3晶体,盖好表面皿。
21(10分)为了减少污染,使实验绿色化,学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如右图所示),在圆心处放置2粒芝麻大小的KClO3晶体,盖好表面皿。
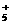 +H2O N2H4+H2O
+H2O N2H4+H2O N2H
N2H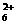 +OH- N2H
+OH- N2H