10. ( 德州市) 下图为短周期的一部分,推断关于Y、Z、M的说法正确的是( )
|
|
X |
|
|
|
Y |
|
|
Z |
M |
|
A. 非金属性:Y>Z>M
B. 原子半径:M>Z>Y
C. 气态氢化物的稳定性:Y<M<Z
D.
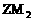 分子中各原子的最外层电子均满足
分子中各原子的最外层电子均满足 稳定结构
稳定结构

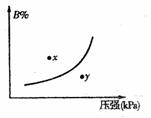 11.(济宁市)反应mA(固)+nB(g) pC(g),△H<0,在一定温度下,
11.(济宁市)反应mA(固)+nB(g) pC(g),△H<0,在一定温度下,
平衡时B的体积分数(B%)与压强变化的关系如图所示,下列
叙述中一定正确的是 ( )
①m+n>p
②x点表示的正反应速度大于逆反应速率
|
④x点比y点时的反应速率慢
⑤若升高温度,该反应的平衡常数增大
A.①②⑤ B.只有②④ C.只有①③ D.只有①③⑤
 CH3COO-+H2O
CH3COOH+OH-使得溶液中的c(OH-)>c(H+)
CH3COO-+H2O
CH3COOH+OH-使得溶液中的c(OH-)>c(H+)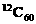 所含的分子个数
B. 1mol HCl溶于水中
所含的分子个数
B. 1mol HCl溶于水中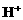 的个数
的个数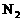 所含的分子数
D. 常温常压下,0.1mol羟基(-OH)所含电子的个数
所含的分子数
D. 常温常压下,0.1mol羟基(-OH)所含电子的个数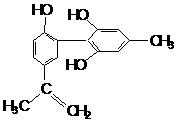 我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如下图所示,有关该物质的说法正确的是
( )
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如下图所示,有关该物质的说法正确的是
( )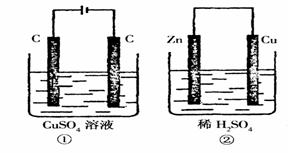 附10.如图所示的两个实验装置中,溶液的体积均为200mL,
附10.如图所示的两个实验装置中,溶液的体积均为200mL, B.电极上析出物质的质量:①>②
B.电极上析出物质的质量:①>②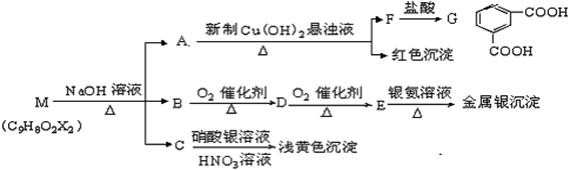 (15分)现有分子式为C9H8O2X2(X为一未知元素)的物质M,可在一定条件下发生上述一系列反应,试回答下列问题:
(15分)现有分子式为C9H8O2X2(X为一未知元素)的物质M,可在一定条件下发生上述一系列反应,试回答下列问题: