6、(10分)氯酸钾是一种强氧化剂,多用来制造火柴和烟花等。制取氯酸钾的方法有如下两种。
第一种:无隔膜电解热的氯化钾水溶液,电解的生成物相互反应制得氯酸钾。
(1)电解池中电极反应的方程式是
阴极: ,阳极: 。
(2)写出生成氯酸钾的离子方程式,并标明电子转移的方向和数目 。
第二种:无隔膜电解热的氯化钠水溶液,然后用电解后溶液中的一种产物与等物质的量的氯化钾水溶液混合制得氯酸钾。
(3)第二种方法中制得氯酸钾的化学方程式是 ,该反应能够进行的原因 。
(4)已知下列各物质的价格如下表:
|
物质 |
NaCl |
KCl |
NaClO3 |
KClO3 |
KOH |
|
价格(元/50kg) |
500 |
1900 |
4200 |
26000 |
10600 |
从经济效益分析,上述方法中的第 种方法更好,理由是 。
答案(共10分)
① 2H++2e-==H2↑(1分),2Cl--2e-== Cl 2↑(1分)
②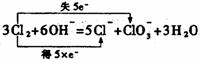 (2分)
(2分)
③NaClO3+KCl==KClO3+NaCl(2分);四种物质中氯酸钾的溶解度最小,可以从溶液中析出,使反应向着生成氯酸钾的方向进行。(2分)
④第二种(1分)第一种方法中生成KClO3时只利用了原料KCl的1/6,其余5/6又恢复为原料KCl,而KCl的价格高于NaCl,这在经济上是低效益的。(2分)
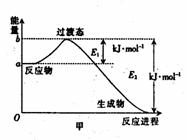
2、(1)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成,而是在反应物到生成物的过程中经过一个高能量的过渡态。图甲 是白磷(P4)和O2反应生成P4O10过程中能量变化示意图,请写出白磷(P4)和O2反应生成P4O10的热化学方程式:____________(△H用含E1和E2的代数式表示,其中E1、E2均大于0)。
 (2)白磷(图乙)是正四面体构型的分子,当与氧气作用形成P4O6时,相当于每两个磷原子之间插入一个氧原子(如图丙)。当形成P4O10时,相当于在P4O6的分子中每个磷原子又以双键结合一个氧原子(如图丁)。
(2)白磷(图乙)是正四面体构型的分子,当与氧气作用形成P4O6时,相当于每两个磷原子之间插入一个氧原子(如图丙)。当形成P4O10时,相当于在P4O6的分子中每个磷原子又以双键结合一个氧原子(如图丁)。
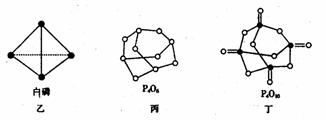
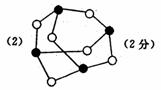
请在图丙的示意图中把磷原子用钢笔或铅笔把磷原子涂黑。
(3)进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关。键能可以简单的理解为断开1mol化学键时所需吸收的能量。下表是部分化学键的键能数据:
|
化学键 |
P-P |
P-O |
O=O |
P=O |
|
键能/kJ·mol-1 |
198 |
360 |
498 |
X |
已知白磷(P4)的燃烧热为2982kJ·mol-1,白磷完全燃烧的产物结构如图丁所示,则上表中x=______
(4)写出1molP4与O2反应生成固态P4O6的反应热△H=_____________。
(1)P4(s) + 5O2(g) === P4O10(s); △h=-(E2-E1)kJ·mol-1
 (3)585 (4)发638kJ·mol-1
(3)585 (4)发638kJ·mol-1

 (1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 。
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 。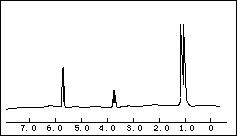 5.8g某含氧衍生物在足量的氧气中完全燃烧,将产生的高温气体依次通过浓硫酸和氢氧化钠溶液,使浓硫酸增重5.4g,氢氧化钠溶液增重13.2g。对该物质进行质谱分析,在所得的质谱图中有质荷比分别的27、29、31、44、50、58六条谱线,下图是该物质的核磁共振氢谱,并且峰面积比分别为1:1:6,
5.8g某含氧衍生物在足量的氧气中完全燃烧,将产生的高温气体依次通过浓硫酸和氢氧化钠溶液,使浓硫酸增重5.4g,氢氧化钠溶液增重13.2g。对该物质进行质谱分析,在所得的质谱图中有质荷比分别的27、29、31、44、50、58六条谱线,下图是该物质的核磁共振氢谱,并且峰面积比分别为1:1:6,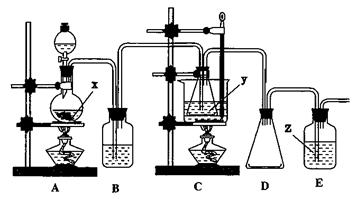 回答下列问题:
回答下列问题:
 ⑶ 不合理 我的猜想是[Fe(SCN)]2+离子中的SCN-被过量的氯水氧化。设计的实验为在褪色后溶液加入FeCl3溶液,仍不变红色(或在褪色后溶液加入加入KSCN溶液,变红色)
⑶ 不合理 我的猜想是[Fe(SCN)]2+离子中的SCN-被过量的氯水氧化。设计的实验为在褪色后溶液加入FeCl3溶液,仍不变红色(或在褪色后溶液加入加入KSCN溶液,变红色)