网址:http://m.1010jiajiao.com/timu3_id_376642[举报]
Ⅰ.实验步骤:
(1)用滴定管吸取10mL市售白醋样品,置于100mL容量瓶中,加蒸馏水(煮沸除去CO2并迅速冷却)稀释至刻度线,摇匀即得待测食醋溶液.
(2)用酸式滴定管取待测食醋溶液20.00mL于
(3)盛装标准NaOH溶液,静置后,读取数据,记录为NaOH标准溶液体积的初读数.
(4)滴定,并记录NaOH的终读数.重复滴定2-3次.
Ⅱ.实验记录及数据处理
| 滴定次数 实验数据 |
1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(终读数) | 14.98 | 15.20 | 15.12 | 15.95 |
| V(NaOH)/mL(消耗) | 14.98 | 15.00 | 15.02 | 15.95 |
①步骤(2)使用到的仪器名称为:
②下列可用于测定溶液pH且精确度最高的是
A酸碱指示剂 B pH计 C精密pH试纸 D广泛pH试纸
③若用标准盐酸溶液滴定NaOH溶液时,由滴定前仰视读数,滴定结束时俯视读数,这样使求得的NaOH的物质的量浓度
A.偏低 B.偏高 C.偏低或偏高或不能确定 D.不受影响
④在酸碱中和滴定法测定食醋的总酸量的实验中根据上面的实验数据则c(样品)/moL?L-1=
某实验小组拟用酸碱中和滴定法测定食醋的总酸量(g/100mL),现邀请你参与本实验并回答相关问题.(有关实验药品为:市售食用白醋样品500mL、0.1000mol/LNaOH标准溶液、蒸馏水、0.1%甲基橙溶液、0.1%酚酞溶液、0.1%石蕊溶液.)
Ⅰ.实验步骤:
(1)用滴定管吸取10mL市售白醋样品,置于100mL容量瓶中,加蒸馏水(煮沸除去CO2并迅速冷却))稀释至刻度线,摇匀即得待测食醋溶液.
(2)用酸式滴定管取待测食醋溶液20.00mL于______中.
(3)盛装标准NaOH溶液,静置后,读取数据,记录为NaOH标准溶液体积的初读数.
(4)滴定,并记录NaOH的终读数.重复滴定2-3次.
Ⅱ.实验记录及数据处理
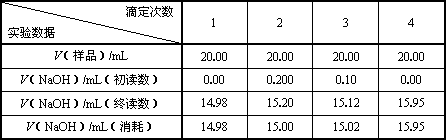
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(终读数) | 14.98 | 15.20 | 15.12 | 15.95 |
| V(NaOH)/mL(消耗) | 14.98 | 15.00 | 15.02 | 15.95 |
Ⅲ.交流与讨论:
(1)甲同学在处理数据过程中计算得:V(NaOH)(平均消耗)=1/4(14.98+15.00+15.02+15.95)mL=15.24mL.
试分析他的计算是否合理,如果不合理请说明理由:______.
(2)乙同学用0.1000mol/LNaOH溶液滴定另一市售白醋样品溶液时,滴定过程中使用pH计将溶液的pH变化情况记录如下表.
| V(NaOH)/mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 |
| 溶液pH | 2.88 | 4.70 | 5.70 | 6.74 | 7.74 | 8.72 | 9.70 | 10.70 | 11.70 |
②由表和图可知:在允许的误差范围(±0.1%)内,pH突变(滴定突跃)范围为______.所以可选择______作指示剂.
附:常见指示剂的变色范围
| 指示剂 | 变色的范围(pH) |
| 甲基橙 | 3.1~4.4 |
| 石蕊 | 5.0~8.0 |
| 酚酞 | 8.2~10.0 |
某实验小组拟用酸碱中和滴定法测定食醋的总酸量(g/100 mL),现邀请你参与本实验并回答相关问题.(有关实验药品为:市售食用白醋样品500 mL、0.1000 mol/LNaOH标准溶液、蒸馏水、0.1%甲基橙溶液、0.1%酚酞溶液、0.1%石蕊溶液.)
Ⅰ.实验步骤:
(1)用滴定管吸取10 mL市售白醋样品,置于100 mL容量瓶中,加蒸馏水(煮沸除去CO2并迅速冷却))稀释至刻度线,摇匀即得待测食醋溶液.
(2)用酸式滴定管取待测食醋溶液20.00 mL于________中.
(3)盛装标准NaOH溶液,静置后,读取数据,记录为NaOH标准溶液体积的初读数.
(4)滴定,并记录NaOH的终读数.重复滴定2-3次.
Ⅱ.实验记录及数据处理
则c(样品)/moL·L-1=________;样品总酸量g / 100mL=________.
Ⅲ.交流与讨论:
(1)甲同学在处理数据过程中计算得:
V(NaOH)(平均消耗)=1/4(14.98+15.00+15.02+15.95)mL=15.24 mL.
试分析他的计算是否合理,如果不合理请说明理由.
________________________________________________________________.
(2)乙同学用0.1000 mol/L NaOH溶液滴定另一市售白醋样品溶液时,滴定过程中使用pH计将溶液的pH变化情况记录如下表.
①请作出pH-V(NaOH)图.
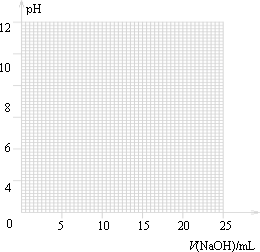
①由表和图可知:在允许的误差范围(±0.1%)内,pH突变
(滴定突跃)范围为________.
所以可选择________作指示剂.
附:常见指示剂的变色范围

Ⅰ.实验步骤:
(1)用滴定管吸取10mL市售白醋样品,置于100mL容量瓶中,加蒸馏水(煮沸除去CO2并迅速冷却))稀释至刻度线,摇匀即得待测食醋溶液.
(2)用酸式滴定管取待测食醋溶液20.00mL于
(3)盛装标准NaOH溶液,静置后,读取数据,记录为NaOH标准溶液体积的初读数.
(4)滴定,并记录NaOH的终读数.重复滴定2-3次.
Ⅱ.实验记录及数据处理
| 滴定次数 实验数据 |
1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(终读数) | 14.98 | 15.20 | 15.12 | 15.95 |
| V(NaOH)/mL(消耗) | 14.98 | 15.00 | 15.02 | 15.95 |
Ⅲ.交流与讨论:
(1)甲同学在处理数据过程中计算得:V(NaOH)(平均消耗)=1/4(14.98+15.00+15.02+15.95)mL=15.24mL.
试分析他的计算是否合理,如果不合理请说明理由:
(2)乙同学用0.1000mol/LNaOH溶液滴定另一市售白醋样品溶液时,滴定过程中使用pH计将溶液的pH变化情况记录如下表.
| V(NaOH)/mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 |
| 溶液pH | 2.88 | 4.70 | 5.70 | 6.74 | 7.74 | 8.72 | 9.70 | 10.70 | 11.70 |
②由表和图可知:在允许的误差范围(±0.1%)内,pH突变(滴定突跃)范围为
附:常见指示剂的变色范围
| 指示剂 | 变色的范围(pH) |
| 甲基橙 | 3.1~4.4 |
| 石蕊 | 5.0~8.0 |
| 酚酞 | 8.2~10.0 |
Ⅰ.某实验A小组设计生产亚氯酸钠(NaClO2)的主要流程如图,

已知NaClO2是一种强氧化性漂白剂,广泛用于纺织、印染工业。它在碱性环境中稳定存在。
(1)双氧水的电子式为??????????? ,装置Ⅰ中发生反应的还原剂是 (填化学式)。
(2)A的化学式是 ? ,装置Ⅲ电解池中A在 极区产生,若装置Ⅲ中生成气体a为 11.2 L(标准状况),则理论上通过电解池的电量为 ????????????? (已知法拉第常数F=9.65×l 04C· mol-1)。
(3)装置Ⅱ中反应的离子方程式是 ???????????????????????? 。
Ⅱ.某实验B小组测定金属锡合金样品的纯度(仅含少量锌和铜,组成均匀),将样品溶于足量盐酸: Sn+ 2HCl=SnCl2+H2↑,过滤,洗涤。将滤液和洗涤液合并再加过量的FeCl3溶液。最后可用一定浓度的K2Cr2O7酸性溶液滴定生成的Fe2+,此时还原产物为Cr3+。现有锡合金试样1.23g,经上述反应、操作后,共用去0.200mol/L的K2Cr2O7的酸性溶液15.00mL。
(4) 列式计算样品中锡的质量分数。
(5)用上述样品模拟工业上电解精炼锡,如图:

b极发生电极反应式?????? ,当得到11.90g纯锡时,电解质溶液质量减轻0.54g,则锡合金质量减少_______ g(结果保留一位小数)。
查看习题详情和答案>>