摘要:02+15.95)mL=15.24mL.试分析他的计算是否合理.如果不合理请说明理由. . ⑵乙同学用0.1000mol / LNaOH溶液滴定另一市售白醋样品溶液时.滴定过程中使用pH计将溶液的pH变化情况记录如下表. V/mL 0.00 10.00 18.00 19.80 19.98 20.00 20.02 20.20 22.00 溶液pH 2.88 4.70 5.70 6.74 7.74 8.72 9.70 10.70 11.70 ①请作出pH-V图. ②由表和图可知:在允许的误差范围内.pH突变范围为 .所以可选择 作指示剂. 附:常见指示剂的变色范围 指示剂 变色的范围(pH) 甲基橙 3.1-4.4 石蕊 5.0-8.0 酚酞 8.2-10.0
网址:http://m.1010jiajiao.com/timu3_id_376643[举报]
(2009?淮安二模)某实验小组拟用酸碱中和滴定法测定食醋的总酸量(g/100mL),现邀请你参与本实验并回答相关问题.(有关实验药品为:市售食用白醋样品500mL、0.1000mol/LNaOH标准溶液、蒸馏水、0.1%甲基橙溶液、0.1%酚酞溶液、0.1%石蕊溶液.)
Ⅰ.实验步骤:
(1)用滴定管吸取10mL市售白醋样品,置于100mL容量瓶中,加蒸馏水(煮沸除去CO2并迅速冷却))稀释至刻度线,摇匀即得待测食醋溶液.
(2)用酸式滴定管取待测食醋溶液20.00mL于
(3)盛装标准NaOH溶液,静置后,读取数据,记录为NaOH标准溶液体积的初读数.
(4)滴定,并记录NaOH的终读数.重复滴定2-3次.
Ⅱ.实验记录及数据处理
则c(样品)/moL?L-1=
Ⅲ.交流与讨论:
(1)甲同学在处理数据过程中计算得:V(NaOH)(平均消耗)=1/4(14.98+15.00+15.02+15.95)mL=15.24mL.
试分析他的计算是否合理,如果不合理请说明理由:
(2)乙同学用0.1000mol/LNaOH溶液滴定另一市售白醋样品溶液时,滴定过程中使用pH计将溶液的pH变化情况记录如下表.
①请作出pH-V(NaOH)图.
②由表和图可知:在允许的误差范围(±0.1%)内,pH突变(滴定突跃)范围为
附:常见指示剂的变色范围
查看习题详情和答案>>
Ⅰ.实验步骤:
(1)用滴定管吸取10mL市售白醋样品,置于100mL容量瓶中,加蒸馏水(煮沸除去CO2并迅速冷却))稀释至刻度线,摇匀即得待测食醋溶液.
(2)用酸式滴定管取待测食醋溶液20.00mL于
锥形瓶
锥形瓶
中.(3)盛装标准NaOH溶液,静置后,读取数据,记录为NaOH标准溶液体积的初读数.
(4)滴定,并记录NaOH的终读数.重复滴定2-3次.
Ⅱ.实验记录及数据处理
| 滴定次数 实验数据 |
1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(终读数) | 14.98 | 15.20 | 15.12 | 15.95 |
| V(NaOH)/mL(消耗) | 14.98 | 15.00 | 15.02 | 15.95 |
0.75mol/L
0.75mol/L
;样品总酸量g/100mL=4.g/100ml
4.g/100ml
.Ⅲ.交流与讨论:
(1)甲同学在处理数据过程中计算得:V(NaOH)(平均消耗)=1/4(14.98+15.00+15.02+15.95)mL=15.24mL.
试分析他的计算是否合理,如果不合理请说明理由:
不合理,因为第四组数据与前3组相差较大,属异常值,应舍去
不合理,因为第四组数据与前3组相差较大,属异常值,应舍去
.(2)乙同学用0.1000mol/LNaOH溶液滴定另一市售白醋样品溶液时,滴定过程中使用pH计将溶液的pH变化情况记录如下表.
| V(NaOH)/mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 |
| 溶液pH | 2.88 | 4.70 | 5.70 | 6.74 | 7.74 | 8.72 | 9.70 | 10.70 | 11.70 |

②由表和图可知:在允许的误差范围(±0.1%)内,pH突变(滴定突跃)范围为
7.74~9.70
7.74~9.70
.所以可选择酚酞
酚酞
作指示剂.附:常见指示剂的变色范围
| 指示剂 | 变色的范围(pH) |
| 甲基橙 | 3.1~4.4 |
| 石蕊 | 5.0~8.0 |
| 酚酞 | 8.2~10.0 |
某实验小组拟用酸碱中和滴定法测定食醋的总酸量(g/100mL),现邀请你参与本实验并回答相关问题.(有关实验药品为:市售食用白醋样品500mL、0.1000mol/L NaOH标准溶液、蒸馏水、0.1%甲基橙溶液、0.1%酚酞溶液、0.1%石蕊溶液.)
Ⅰ.实验步骤:
(1)用滴定管吸取10mL市售白醋样品,置于100mL容量瓶中,加蒸馏水(煮沸除去CO2并迅速冷却)稀释至刻度线,摇匀即得待测食醋溶液.
(2)用酸式滴定管取待测食醋溶液20.00mL于 中.
(3)盛装标准NaOH溶液,静置后,读取数据,记录为NaOH标准溶液体积的初读数.
(4)滴定,并记录NaOH的终读数.重复滴定2-3次.
Ⅱ.实验记录及数据处理
回答下面的问题
①步骤(2)使用到的仪器名称为:
②下列可用于测定溶液pH且精确度最高的是
A酸碱指示剂 B pH计 C精密pH试纸 D广泛pH试纸
③若用标准盐酸溶液滴定NaOH溶液时,由滴定前仰视读数,滴定结束时俯视读数,这样使求得的NaOH的物质的量浓度
A.偏低 B.偏高 C.偏低或偏高或不能确定 D.不受影响
④在酸碱中和滴定法测定食醋的总酸量的实验中根据上面的实验数据则c(样品)/moL?L-1= ;样品总酸量g/100mL= .
查看习题详情和答案>>
Ⅰ.实验步骤:
(1)用滴定管吸取10mL市售白醋样品,置于100mL容量瓶中,加蒸馏水(煮沸除去CO2并迅速冷却)稀释至刻度线,摇匀即得待测食醋溶液.
(2)用酸式滴定管取待测食醋溶液20.00mL于
(3)盛装标准NaOH溶液,静置后,读取数据,记录为NaOH标准溶液体积的初读数.
(4)滴定,并记录NaOH的终读数.重复滴定2-3次.
Ⅱ.实验记录及数据处理
| 滴定次数 实验数据 |
1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(终读数) | 14.98 | 15.20 | 15.12 | 15.95 |
| V(NaOH)/mL(消耗) | 14.98 | 15.00 | 15.02 | 15.95 |
①步骤(2)使用到的仪器名称为:
②下列可用于测定溶液pH且精确度最高的是
A酸碱指示剂 B pH计 C精密pH试纸 D广泛pH试纸
③若用标准盐酸溶液滴定NaOH溶液时,由滴定前仰视读数,滴定结束时俯视读数,这样使求得的NaOH的物质的量浓度
A.偏低 B.偏高 C.偏低或偏高或不能确定 D.不受影响
④在酸碱中和滴定法测定食醋的总酸量的实验中根据上面的实验数据则c(样品)/moL?L-1=
某实验小组拟用酸碱中和滴定法测定食醋的总酸量(g/100mL),现邀请你参与本实验并回答相关问题.(有关实验药品为:市售食用白醋样品500mL、0.1000mol/LNaOH标准溶液、蒸馏水、0.1%甲基橙溶液、0.1%酚酞溶液、0.1%石蕊溶液.)
Ⅰ.实验步骤:
(1)用滴定管吸取10mL市售白醋样品,置于100mL容量瓶中,加蒸馏水(煮沸除去CO2并迅速冷却))稀释至刻度线,摇匀即得待测食醋溶液.
(2)用酸式滴定管取待测食醋溶液20.00mL于______中.
(3)盛装标准NaOH溶液,静置后,读取数据,记录为NaOH标准溶液体积的初读数.
(4)滴定,并记录NaOH的终读数.重复滴定2-3次.
Ⅱ.实验记录及数据处理
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(终读数) | 14.98 | 15.20 | 15.12 | 15.95 |
| V(NaOH)/mL(消耗) | 14.98 | 15.00 | 15.02 | 15.95 |
Ⅲ.交流与讨论:
(1)甲同学在处理数据过程中计算得:V(NaOH)(平均消耗)=1/4(14.98+15.00+15.02+15.95)mL=15.24mL.
试分析他的计算是否合理,如果不合理请说明理由:______.
(2)乙同学用0.1000mol/LNaOH溶液滴定另一市售白醋样品溶液时,滴定过程中使用pH计将溶液的pH变化情况记录如下表.
| V(NaOH)/mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 |
| 溶液pH | 2.88 | 4.70 | 5.70 | 6.74 | 7.74 | 8.72 | 9.70 | 10.70 | 11.70 |
②由表和图可知:在允许的误差范围(±0.1%)内,pH突变(滴定突跃)范围为______.所以可选择______作指示剂.
附:常见指示剂的变色范围
| 指示剂 | 变色的范围(pH) |
| 甲基橙 | 3.1~4.4 |
| 石蕊 | 5.0~8.0 |
| 酚酞 | 8.2~10.0 |
某实验小组拟用酸碱中和滴定法测定食醋的总酸量(g/100 mL),现邀请你参与本实验并回答相关问题.(有关实验药品为:市售食用白醋样品500 mL、0.1000 mol/LNaOH标准溶液、蒸馏水、0.1%甲基橙溶液、0.1%酚酞溶液、0.1%石蕊溶液.)
Ⅰ.实验步骤:
(1)用滴定管吸取10 mL市售白醋样品,置于100 mL容量瓶中,加蒸馏水(煮沸除去CO2并迅速冷却))稀释至刻度线,摇匀即得待测食醋溶液.
(2)用酸式滴定管取待测食醋溶液20.00 mL于________中.
(3)盛装标准NaOH溶液,静置后,读取数据,记录为NaOH标准溶液体积的初读数.
(4)滴定,并记录NaOH的终读数.重复滴定2-3次.
Ⅱ.实验记录及数据处理
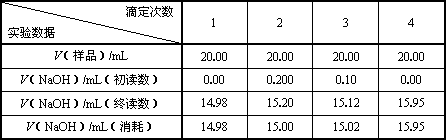
则c(样品)/moL·L-1=________;样品总酸量g / 100mL=________.
Ⅲ.交流与讨论:
(1)甲同学在处理数据过程中计算得:
V(NaOH)(平均消耗)=1/4(14.98+15.00+15.02+15.95)mL=15.24 mL.
试分析他的计算是否合理,如果不合理请说明理由.
________________________________________________________________.
(2)乙同学用0.1000 mol/L NaOH溶液滴定另一市售白醋样品溶液时,滴定过程中使用pH计将溶液的pH变化情况记录如下表.
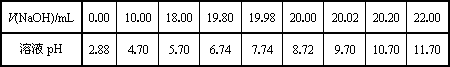
①请作出pH-V(NaOH)图.
①由表和图可知:在允许的误差范围(±0.1%)内,pH突变
(滴定突跃)范围为________.
所以可选择________作指示剂.
附:常见指示剂的变色范围

食醋分为酿造醋和配制醋两种.国家标准规定酿造食醋总酸含量不得低于3.5g/100mL.某研究性学习小组欲测定市售食醋总酸含量,设计如下实验步骤.
用移液管移取10mL市售食醋,置于100mL容量瓶中,加水稀释至刻度线,从中取出食醋溶液20mL于锥形瓶中,并滴加
(1)把上述步骤中的两处空白补充完整.
(2)①该市售食醋的总酸量为
②下列操作会导致所测食醋中总酸含量偏高的是
A、配制醋酸溶液时,加水超过刻度线,用吸管吸出.
B、碱式滴定管未用标准NaOH溶液润洗
C、读取NaOH溶液体积时,初读数时仰视,终读数时俯视
D、装食醋溶液的锥形瓶未用食醋溶液润洗
(3)研究小组的同学仔细观察了该品牌食醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与食品添加剂(苯甲酸钠C6H5COONa)不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的
a.pH b.电离度 c.电离常数 d.溶解度
(4)常温下,用0.1000mol?L-1NaOH溶液分别滴定20.00mL 0.1000mol?L-1HCl溶液和20.00mL 0.1000mol?L-1CH3COOH溶液,得到2条滴定曲线,如图所示.

①滴定醋酸溶液的曲线是
②E点pH>8的原因用离子方程式表示
查看习题详情和答案>>
用移液管移取10mL市售食醋,置于100mL容量瓶中,加水稀释至刻度线,从中取出食醋溶液20mL于锥形瓶中,并滴加
酚酞
酚酞
2-3滴.将碱式滴定管洗净后,用NaOH标准溶液润洗3次,然后加入NaOH标准溶液,排除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下.静置后,读取数据,记录为NaOH标准溶液体积的初读数.用0.1000mol?L-NaOH标准溶液进行滴定,当看到溶液的颜色由无色变浅红且保持30秒内不褪色
溶液的颜色由无色变浅红且保持30秒内不褪色
时,停止滴定,记录NaOH的终读数.重复滴定3次.实验有关数据如表所示:| 滴定次数 实验数据 |
1 | 2 | 3 | 4 |
| V(醋酸溶液)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(终读数) | 14.98 | 15.20 | 15.12 | 15.95 |
(2)①该市售食醋的总酸量为
4.50
4.50
(g/100mL).是否合格?是
是
(_填“是”或“否”).②下列操作会导致所测食醋中总酸含量偏高的是
B
B
.A、配制醋酸溶液时,加水超过刻度线,用吸管吸出.
B、碱式滴定管未用标准NaOH溶液润洗
C、读取NaOH溶液体积时,初读数时仰视,终读数时俯视
D、装食醋溶液的锥形瓶未用食醋溶液润洗
(3)研究小组的同学仔细观察了该品牌食醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与食品添加剂(苯甲酸钠C6H5COONa)不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的
c
c
(填写序号).a.pH b.电离度 c.电离常数 d.溶解度
(4)常温下,用0.1000mol?L-1NaOH溶液分别滴定20.00mL 0.1000mol?L-1HCl溶液和20.00mL 0.1000mol?L-1CH3COOH溶液,得到2条滴定曲线,如图所示.

①滴定醋酸溶液的曲线是
图2
图2
(填“图l”或“图2”);滴定曲线中a=20.00
20.00
mL;②E点pH>8的原因用离子方程式表示
CH3COO-+H2O?CH3COOH+OH-
CH3COO-+H2O?CH3COOH+OH-
.