0 37480 37488 37494 37498 37504 37506 37510 37516 37518 37524 37530 37534 37536 37540 37546 37548 37554 37558 37560 37564 37566 37570 37572 37574 37575 37576 37578 37579 37580 37582 37584 37588 37590 37594 37596 37600 37606 37608 37614 37618 37620 37624 37630 37636 37638 37644 37648 37650 37656 37660 37666 37674 447348
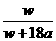 ×100%
B.
×100%
B. ×100%
×100%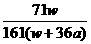 ×100%
D.
×100%
D.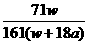 ×100%
×100%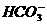 ====
CaCO3↓+2H2O+
====
CaCO3↓+2H2O+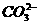
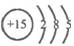 ,作出如下推理,其中与事实不符的是( )
,作出如下推理,其中与事实不符的是( )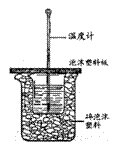 用右图所示装置进行中和热测定实验,请回答下列问题:
(1)大小烧杯之间填满碎泡沫塑料的作用是
,从实验装置上看,图中缺少的一种玻璃仪器是
。
(2)使用补全仪器后的装置进行实验,取50mL 0.25mol/L H2SO4溶液与50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。已知中和后生成的溶液的 比热容为4.18J/(g·℃),溶液的密度均为1g/cm3。通过计算可得中和热△H=
,H2SO4与NaOH反应的热化学方程式为
。
(3)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量
(填“相等”、“不相等”),所求中和热 (填“相等”、“不相等”);,若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会 (填“偏大”、“偏小”、“不受影响”)。
10、A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素;A、B,C三种元素的原子序数之和为31;D元素与A、B、C三种元素处于不同周期。请填空:
(1)C元素的名称 ,A、D两种元素形成的离子电子式为
。
(2)A、B、C、D四种元素组成的正盐的水溶液显酸性,用离子方程式表示其原因:
(3)BD3与BA2的反应常用于某工业尾气的处理,该反应的化学方程式为
。
(4)D2C和D2A2溶液反应生成了C的单质,该反应的化学方程式为
。
11、在一定温度下,将2mol A和2mol B两种气体混合于2L密闭容器中,发生如下反应:2A(g)+B(g)
用右图所示装置进行中和热测定实验,请回答下列问题:
(1)大小烧杯之间填满碎泡沫塑料的作用是
,从实验装置上看,图中缺少的一种玻璃仪器是
。
(2)使用补全仪器后的装置进行实验,取50mL 0.25mol/L H2SO4溶液与50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。已知中和后生成的溶液的 比热容为4.18J/(g·℃),溶液的密度均为1g/cm3。通过计算可得中和热△H=
,H2SO4与NaOH反应的热化学方程式为
。
(3)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量
(填“相等”、“不相等”),所求中和热 (填“相等”、“不相等”);,若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会 (填“偏大”、“偏小”、“不受影响”)。
10、A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素;A、B,C三种元素的原子序数之和为31;D元素与A、B、C三种元素处于不同周期。请填空:
(1)C元素的名称 ,A、D两种元素形成的离子电子式为
。
(2)A、B、C、D四种元素组成的正盐的水溶液显酸性,用离子方程式表示其原因:
(3)BD3与BA2的反应常用于某工业尾气的处理,该反应的化学方程式为
。
(4)D2C和D2A2溶液反应生成了C的单质,该反应的化学方程式为
。
11、在一定温度下,将2mol A和2mol B两种气体混合于2L密闭容器中,发生如下反应:2A(g)+B(g)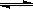 C(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD。
请填写下列空白:
(1)从反应开始至达到平衡,用D表示的平均反应速率为
。
(2)B的平衡浓度为
,A的转化率为
。
(3)在温度不变时,如果缩小容器体积,平衡体系中混合气体的密度
、平均相对分子质量
。(两空均填“增大”、“减少”或“不变”)
(4)如果上述反应在相同条件下从逆反应开始进行,最初加C和D各2mol,要使平衡时各物质的体积分数与原平衡相等,则还应加入
mol B物质。
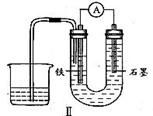
12、用下图I所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升。
C(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD。
请填写下列空白:
(1)从反应开始至达到平衡,用D表示的平均反应速率为
。
(2)B的平衡浓度为
,A的转化率为
。
(3)在温度不变时,如果缩小容器体积,平衡体系中混合气体的密度
、平均相对分子质量
。(两空均填“增大”、“减少”或“不变”)
(4)如果上述反应在相同条件下从逆反应开始进行,最初加C和D各2mol,要使平衡时各物质的体积分数与原平衡相等,则还应加入
mol B物质。
12、用下图I所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升。
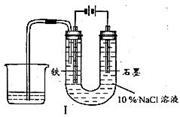
 (1)用装置1电解食盐水时,总反应的离子方程式为
,为什么石墨电极上方得到气体的体积比铁电极上方得到气体的体积小得多?
。如果所用食盐水中含有MgCl2杂质,在电解过程中还可以观察到的现象是 。
(2)用装置Ⅱ进行实验时,有关电极反应式为:铁电极
,石墨电极
。
(1)用装置1电解食盐水时,总反应的离子方程式为
,为什么石墨电极上方得到气体的体积比铁电极上方得到气体的体积小得多?
。如果所用食盐水中含有MgCl2杂质,在电解过程中还可以观察到的现象是 。
(2)用装置Ⅱ进行实验时,有关电极反应式为:铁电极
,石墨电极
。