摘要: (2) (3) (4)盐酸的物质的量浓度 (5)
网址:http://m.1010jiajiao.com/timu3_id_375559[举报]
将2.3g金属钠投入100g水中,反应结束后,溶液中溶质的质量分数计算式表示正确的是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
某学生在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,整个溶液几乎没有什么变化,但溶液加热后,显明显淡红色,加热较长时间后冷却,红色不褪去.该学生为了了解该过程的原因,进行了下列探究过程:
[实验探究]
实验1:加热0.1mol/LNaHCO3溶液,测得溶液pH变化如下表
实验2:10℃时,在烧杯中加入0.1mol/LNaHCO3溶液200mL,测得该溶液pH=8.3,加热到100℃,测得pH=10.2,恢复到10℃,pH=9.8.
实验3:加热0.1mol/LNaHCO3溶液,将产生的气体通入澄清石灰水,溶液变浑浊.
实验4:
①配制0.1mol/LNaHCO3溶液和0.1mol/LNa2CO3溶液各200mL,10℃时,分别测得NaHCO3溶液pH=8.3,Na2CO3溶液pH=11.5.
②加热蒸发0.1mol/L NaHCO3溶液200mL,至溶液体积100mL,停止加热,加水至200mL,冷却至原温度,测得溶液pH=9.8.
③将0.1mol/L NaHCO3溶液200mL敞口放置三天,再加水至200mL,测得溶液pH=10.1.
请根据上述实验回答下列问题:
(1)用离子方程式表示0.1mol/LNaHCO3溶液中存在的平衡(除水电离平衡外)
(2)实验3得到的结论是
(3)结合实验2、3分析,加热0.1mol/LNaHCO3溶液,pH增大的原因可能是
(4)实验4①得到的结论是
(5)实验4②“加水至200mL”的目的是
实验4③可以得到的结论是
(6)要确定NaHCO3溶液加热后pH增大的主要原因还需要解决的问题是
查看习题详情和答案>>
[实验探究]
实验1:加热0.1mol/LNaHCO3溶液,测得溶液pH变化如下表
| 温度(℃) | 10 | 20 | 30 | 50 | 70 | 80 | 100 |
| pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 | 9.6 | 10.1 |
实验3:加热0.1mol/LNaHCO3溶液,将产生的气体通入澄清石灰水,溶液变浑浊.
实验4:
①配制0.1mol/LNaHCO3溶液和0.1mol/LNa2CO3溶液各200mL,10℃时,分别测得NaHCO3溶液pH=8.3,Na2CO3溶液pH=11.5.
②加热蒸发0.1mol/L NaHCO3溶液200mL,至溶液体积100mL,停止加热,加水至200mL,冷却至原温度,测得溶液pH=9.8.
③将0.1mol/L NaHCO3溶液200mL敞口放置三天,再加水至200mL,测得溶液pH=10.1.
请根据上述实验回答下列问题:
(1)用离子方程式表示0.1mol/LNaHCO3溶液中存在的平衡(除水电离平衡外)
HCO3-?CO32-+H+
HCO3-?CO32-+H+
、HCO3-+H2O?H2CO3+OH-
HCO3-+H2O?H2CO3+OH-
.这两个平衡以水解平衡
水解平衡
为主,理由是溶液显碱性
溶液显碱性
.(2)实验3得到的结论是
加热0.1mol/LNaHCO3溶液,NaHCO3发生分解反应,产生二氧化碳
加热0.1mol/LNaHCO3溶液,NaHCO3发生分解反应,产生二氧化碳
.(3)结合实验2、3分析,加热0.1mol/LNaHCO3溶液,pH增大的原因可能是
水分蒸发
水分蒸发
、NaHCO3发生分解反应
NaHCO3发生分解反应
、NaHCO3水解平衡被促进
NaHCO3水解平衡被促进
.(4)实验4①得到的结论是
相同温度下,Na2CO3的水解能力和溶液碱性大于NaHCO3
相同温度下,Na2CO3的水解能力和溶液碱性大于NaHCO3
.(5)实验4②“加水至200mL”的目的是
排除因水分蒸发导致pH增大的因素
排除因水分蒸发导致pH增大的因素
.实验4③可以得到的结论是
NaHCO3常温下即可发生分解反应
NaHCO3常温下即可发生分解反应
.(6)要确定NaHCO3溶液加热后pH增大的主要原因还需要解决的问题是
NaHCO3发生分解生成碳酸钠?还是水解平衡向右移动?还是两者皆有
NaHCO3发生分解生成碳酸钠?还是水解平衡向右移动?还是两者皆有
.(2011?顺义区二模)甲烷是一种重要的基础化工原料,不仅可制备多种重要有机产品,还可用于环境保护.请回答下列问题:(1)用甲烷催化还原氮的氧化物可消除氮氧化物的污染.已知:
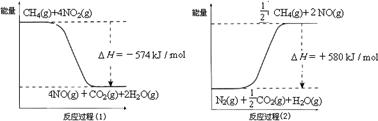
反应过程(2)是
(2)工厂利用甲烷与氯气的反应原理制取氯甲烷,为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应:
CCl4(g)+H2(g)?CHCl3(g)+HCl(g),使CCl4转化为重要的化工原料氯仿(CHCl3)(不考虑副反应).
在固定容积为2L的密闭容器中,该反应达到平衡后,测得如下数据:
①此反应在110℃时平衡常数为
③判断该反应的正反应是
④为提高实验3中CCl4的转化率,可采取的措施是
a.使用高效催化剂 b.向容器中再投入1mol CCl4和1mol H2
c.温度升高到200℃d.向容器中再投入1mol HCl e.向容器中再投入1mol H2.
查看习题详情和答案>>

反应过程(2)是
吸热
吸热
反应(填“放热”或“吸热”),甲烷还原NO2生成H2O(g)、N2和CO2时的热化学方程式是2CH4(g)+4NO2(g)=2CO2(g)+2N2(g)+4H2O(g)△H=-1734kJ/mol
2CH4(g)+4NO2(g)=2CO2(g)+2N2(g)+4H2O(g)△H=-1734kJ/mol
.(2)工厂利用甲烷与氯气的反应原理制取氯甲烷,为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应:
CCl4(g)+H2(g)?CHCl3(g)+HCl(g),使CCl4转化为重要的化工原料氯仿(CHCl3)(不考虑副反应).
在固定容积为2L的密闭容器中,该反应达到平衡后,测得如下数据:
| 实验 序号 |
温度℃ | 初始n(CCl4) (mol) |
初始n(H2) (mol) |
平衡时n(CHCl3) (mol) |
| 1 | 110 | 0.8 | 1.2 | |
| 2 | 110 | 2 | 2 | 1 |
| 3 | 100 | 1 | 1 | 0.6 |
1
1
. ②实验l中,CCl4的转化率为60%
60%
.③判断该反应的正反应是
放热
放热
(填“放热”或“吸热”),理由是温度为100℃时,K=2.25,大于110℃时的平衡常数,所以该反应为放热反应
温度为100℃时,K=2.25,大于110℃时的平衡常数,所以该反应为放热反应
.④为提高实验3中CCl4的转化率,可采取的措施是
e
e
.a.使用高效催化剂 b.向容器中再投入1mol CCl4和1mol H2
c.温度升高到200℃d.向容器中再投入1mol HCl e.向容器中再投入1mol H2.
为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3).
CCl4+H2?CHCl3+HCl此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等.已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃
(1)在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应).
①此反应在110℃时平衡常数为
②实验1中,CCl4的转化率A
③实验2中,10h后达到平衡,H2的平均反应速率为
④实验3中,B的值
A.等于50% B.大于50% C.小于50%
D.从本题资料,无法判断.
查看习题详情和答案>>
CCl4+H2?CHCl3+HCl此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等.已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃
(1)在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应).
| 实验 序号 |
温度℃ | 初始CCl4浓度 (mol?L-1) |
初始H2浓度(mol?L-1) | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | B |
1
1
.②实验1中,CCl4的转化率A
大于
大于
50%(填“大于”、“小于”或“等于”).③实验2中,10h后达到平衡,H2的平均反应速率为
0.05mol/(L?h)
0.05mol/(L?h)
.在此实验的平衡体系中,再加入0.5mol CCl4和1.0mol HCl,平衡将向逆反应
逆反应
方向移动.④实验3中,B的值
B
B
(选填序号)A.等于50% B.大于50% C.小于50%
D.从本题资料,无法判断.