摘要:67.2g 剩余固体的组成 m的取值范围 n的取值范围 只有铜 0<m≤67.20 0<n≤76.8 有铁且有铜 m>67.2 m-67.2<n≤m+9.6
网址:http://m.1010jiajiao.com/timu3_id_375558[举报]
与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池.图是一个乙醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol/L的CuSO4溶液.请回答下列问题:
(1)N的电极反应式为
(2)在此过程中,乙池中某一电极析出金属铜6.4g时,甲池中理论上消耗氧气
(3)在此过程中,若乙池中两电极产生的气体体积恰好相等时(标准状况下),理论上需通入乙醇
(4)工业上可以利用下列反应制取乙醇:
反应I:2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g) 25℃时.K=2.95×1011
反应II:2CO2(g)+4H2(g)
CH3CH2OH(g)+H2O(g)25℃时,K=1.7l×1022
①写出反应I的平衡常数表达式K=
 ,
,
②条件相同时,反应I与反应II相比,转化程度更大的是
③在一定压强下,测得反应I的实验数据如下表:
根据表中数据分析:温度升高,K值
查看习题详情和答案>>

(1)N的电极反应式为
4OH--4e-=O2↑+2H2O
4OH--4e-=O2↑+2H2O
.(2)在此过程中,乙池中某一电极析出金属铜6.4g时,甲池中理论上消耗氧气
1.12
1.12
L(标准状况下).(3)在此过程中,若乙池中两电极产生的气体体积恰好相等时(标准状况下),理论上需通入乙醇
4.6
4.6
g.(4)工业上可以利用下列反应制取乙醇:
反应I:2CO2(g)+6H2(g)
| ||
反应II:2CO2(g)+4H2(g)
| ||
①写出反应I的平衡常数表达式K=


②条件相同时,反应I与反应II相比,转化程度更大的是
反应II
反应II
.③在一定压强下,测得反应I的实验数据如下表:
温度(K) CO2转化率(%) n(H2)/n(CO2) |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
减小
减小
(填“增大”、“减小”或“不变”),提高氢碳比.n(H2)/n(CO2),对生成乙醇有利
有利
(填“不利”或“有利”).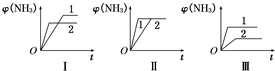 合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷或焦炭与水蒸气反应制得.
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷或焦炭与水蒸气反应制得.(1)在一容积固定的密闭容器中注入N2和H2两种气体,发生上述反应.在某温度下达到平衡时,各物质的浓度分别是:c(H2)=9.00mol?L-1,c(N2)=3.00mol?L-1,c(NH3)=4.00mol?L-1,此温度下该反应的平衡常数K=
0.0073
0.0073
.(2)在三个相同容器中各充入1mol N2和3mol H2,在不同条件下反应并达到平衡,氨的体积分数随时间变化的曲线如图所示.下列说法中正确的是
D
D
(填字母).A.图Ⅰ可能是不同压强对反应的影响,且p2>p1
B.图Ⅱ可能是不同压强对反应的影响,且p1>p2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能1>2
(3)将水蒸气通过红热的炭即可产生水煤气,化学方程式为:
C(s)+H2O(g)═H2(g)+CO(g)△H=+131.3kJ?mol-1,△S=+133.7J?K-1?mol-1
该反应在常温下能否自发进行?
不能
不能
(填“能”或“不能”).一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol/L的NaOH溶液恰好完全吸收,测得溶液中含NaClO的物质的量为0.05mol,则
(1)溶液中含Cl-的物质的量为
(2)所用氯气和参加反应的氢气的物质的量之比为n(Cl2):n(H2)=
查看习题详情和答案>>
(1)溶液中含Cl-的物质的量为
0.25
0.25
mol.(2)所用氯气和参加反应的氢气的物质的量之比为n(Cl2):n(H2)=
3:2
3:2
.常温下将一块钠露置在空气中一段时间后,甲、乙两位同学把固体分成两份,各取一份同时进行实验,欲探究其组成和含量.请根据要求回答下列问题.
甲同学:将一份放入烧瓶中,加入稀硫酸后,生成无色无味的气体,据分析推理可能有二氧化碳和氢气,然后进行气体成份的验证实验.
(1)为验证气体产物中是否含有二氧化碳和氢气,需从下图中选择必要的仪器和药品,设计一套装置验证气体成份.装置的连接顺序为:
d→

(2)实验过程中观察到石灰水变浑浊,由此可判断原固体中含有的物质是
乙同学将另一份进行以下实验.

(3)用浓盐酸配制500mL 3.00mol?L-1的稀盐酸时,需要使用的玻璃仪器除了量筒、烧杯、胶头滴管、玻璃棒以外,还有
(4)在操作II中,发生反应的离子方程式为
(5)操作IV中用盐酸标准液滴定滤液时,滴定终点的现象是
(6)若操作IV中,消耗3.00mol?L-1的盐酸标准液50.00mL,通过计算判断,5.00g固体中是否含有NaOH
查看习题详情和答案>>
甲同学:将一份放入烧瓶中,加入稀硫酸后,生成无色无味的气体,据分析推理可能有二氧化碳和氢气,然后进行气体成份的验证实验.
(1)为验证气体产物中是否含有二氧化碳和氢气,需从下图中选择必要的仪器和药品,设计一套装置验证气体成份.装置的连接顺序为:
d→
e
e
→j
j
→f
f
→b
b
→c
c
→h
h
(填下列装置的接口字母)
(2)实验过程中观察到石灰水变浑浊,由此可判断原固体中含有的物质是
Na2CO3
Na2CO3
(填化学式).乙同学将另一份进行以下实验.

(3)用浓盐酸配制500mL 3.00mol?L-1的稀盐酸时,需要使用的玻璃仪器除了量筒、烧杯、胶头滴管、玻璃棒以外,还有
500mL容量瓶
500mL容量瓶
.(4)在操作II中,发生反应的离子方程式为
Ba2++CO32-=BaCO3↓
Ba2++CO32-=BaCO3↓
.(5)操作IV中用盐酸标准液滴定滤液时,滴定终点的现象是
红色恰好退去
红色恰好退去
.(6)若操作IV中,消耗3.00mol?L-1的盐酸标准液50.00mL,通过计算判断,5.00g固体中是否含有NaOH
有
有
(填有或无),质量是0.4
0.4
g(若你认为无NaOH,则此空不用答).在给定条件下,下列加点的物质在对应的化学反应中能完全耗尽的是( )
A、向100.0mL 3.00mol/L的稀硝酸中加入5.6g
| ||||||||
B、用40.0mL 10.00mol/L的盐酸与10.0g
| ||||||||
C、标准状况下,将1.0g
| ||||||||
D、在50MPa、500℃和铁触媒催化的条件下,用1.2mol
|