18.(16分)电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率。
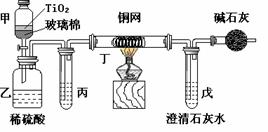
将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200 mL(其中CN-的浓度为0.05 mol·L-)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
|
⑴甲中反应的离子方程式为 ClO- +CN- ======CNO- +Cl- ,
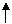
乙中反应的离子方程式为 3ClO- +2CNO- +2H+= 2CO2 +N2+H2O +3Cl- 。
⑵乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等。丙中加入的除杂试剂是饱和食盐水,其作
用是 除去HCL 气体 ,丁在实验中的作用是 除去CL2 ,装有碱石灰的干燥管的作用是 防止空气中的二氧化碳进入戊中影响实验结果 。
⑶戊中盛有含Ca(OH)2 0.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理
的百分率等于 82 % 。该测得值与工业实际处理的百分率相比总是偏低,简要说明可能的原因
有部分的二氧化碳气体留在装置中。请提出一个能提高准确度的建议(要有可操作性,且操作简单) 通入氮气 。
 (1)写出Cu2O跟稀硝酸反应的化学反应方程式3Cu2O+14HNO3=6Cu(NO3)2+2NO
+7H2O;
(1)写出Cu2O跟稀硝酸反应的化学反应方程式3Cu2O+14HNO3=6Cu(NO3)2+2NO
+7H2O; (2)产物中硝酸铜的物质的量0.025mol;
(2)产物中硝酸铜的物质的量0.025mol;
 (3)如混合物中含0.01molCu,则其中Cu2O、CuO的物质的量分别是0.005mol、0.005mol;
(3)如混合物中含0.01molCu,则其中Cu2O、CuO的物质的量分别是0.005mol、0.005mol; (4)如混合物中Cu的物质的量为X,求X的取值范围(0.005、0.015)。
(4)如混合物中Cu的物质的量为X,求X的取值范围(0.005、0.015)。 的尾气中
的尾气中 可用碱性溶液氨水吸收,吸收达到饱和后的溶液再与93%的硫酸反应,可放出
可用碱性溶液氨水吸收,吸收达到饱和后的溶液再与93%的硫酸反应,可放出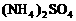 溶液.此法可制得较纯
溶液.此法可制得较纯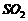 体积分数为0.2%的尾气
体积分数为0.2%的尾气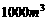 ,问每天要消耗同温同压下(设标准状况)的氨气多少立方米?可得硫酸铵多少千克?
,问每天要消耗同温同压下(设标准状况)的氨气多少立方米?可得硫酸铵多少千克?  在该溶液中肯定存在的离子是H+ 、NH4+、Ba2+、I-,
在该溶液中肯定存在的离子是H+ 、NH4+、Ba2+、I-, 肯定不存在的离子是Mg2+、Ba2+、Al3+、Fe3+、SO42-、CO32-NO3-
肯定不存在的离子是Mg2+、Ba2+、Al3+、Fe3+、SO42-、CO32-NO3- 不能确定是否存在的离子是K+、Na+ C1-。
不能确定是否存在的离子是K+、Na+ C1-。
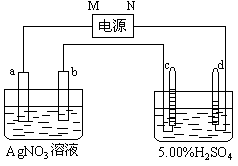 (2)Pt电极上生成的物质是 银 ,其质量为2.16g。
(2)Pt电极上生成的物质是 银 ,其质量为2.16g。 (2)乙同学也用试管取少量雨水,滴入足量BaCl2溶液,发现有少量白色浑浊,写出该实验的化学反应方程
(2)乙同学也用试管取少量雨水,滴入足量BaCl2溶液,发现有少量白色浑浊,写出该实验的化学反应方程 式:BaCl2+H2SO4=BaSO4 +2HCl,乙同学应该得出的结论是:雨水中含硫酸
式:BaCl2+H2SO4=BaSO4 +2HCl,乙同学应该得出的结论是:雨水中含硫酸
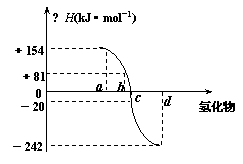 ⑴写出氧族元素中含有18e-的两种氢化物的电子式 略
。
⑴写出氧族元素中含有18e-的两种氢化物的电子式 略
。 系:△H越小非金属元素氢化物越稳定
系:△H越小非金属元素氢化物越稳定