0 37220 37228 37234 37238 37244 37246 37250 37256 37258 37264 37270 37274 37276 37280 37286 37288 37294 37298 37300 37304 37306 37310 37312 37314 37315 37316 37318 37319 37320 37322 37324 37328 37330 37334 37336 37340 37346 37348 37354 37358 37360 37364 37370 37376 37378 37384 37388 37390 37396 37400 37406 37414 447348
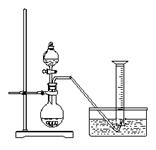 实验步骤:
实验步骤: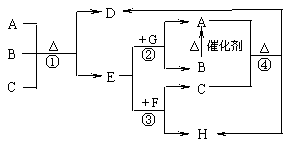 下图中每一字母表示一种反应物或生成物(反应时所需要的水或生成的水均已略去)。已知D是一种盐,焰色反应呈紫色,E在常温下是黄绿色气体,F是一种能使品红溶液褪色的无色气体。
下图中每一字母表示一种反应物或生成物(反应时所需要的水或生成的水均已略去)。已知D是一种盐,焰色反应呈紫色,E在常温下是黄绿色气体,F是一种能使品红溶液褪色的无色气体。