(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较
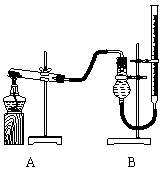 用右图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
用右图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
|
实验序号 |
KClO3质量 |
其它物质质量 |
待测数据 |
|
④ |
1.2
g |
无其他物质 |
|
|
⑤ |
1.2
g |
CuO 0.5
g |
|
|
⑥ |
1.2
g |
MnO2 0.5
g |
|
回答下列问题:
⑶上述实验中的“待测数据”指__________;
⑷本实验装置图中量气装置B由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是__________(填“酸式”或“碱式”)滴定管;
⑸若要证明实验⑤中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上 单孔橡皮塞,
⑹为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a.______,b.CuO的化学性质有没有改变。
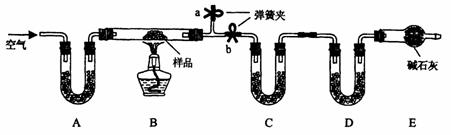
18..(12分)有一含NaCI、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。
(1)加热前通入空气的目的是 ,
操作方法为
(2)装置A、C、D中盛放的试剂分别为 A , C , D
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCI含量将 填(“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中NaHCO3的含量将 ;
若撤去E装置,则测得Na2CO3·10H2O的含量 。
(4)若样品质量为Wg,反应后C、D增加的质量分别为mlg、m2g,由此可知混合物中NaHCO3
质量分数为 。(用含w、mI、m2的代数式表示)


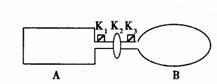 (7分)A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。
(7分)A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。 N2O4;△H<0)
N2O4;△H<0)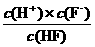 [c(H+)、c(F-)、c(HF)为HF在水溶液中达电离平衡时的浓度]。同样,弱酸盐和弱碱盐的水解程度也可用水解常数(Kh)表示,其计算方法和电离常数一样。资料表明,H2CO3在水中分两步电离,常温时的电离常数分别为K1=4.3×10-7,K2=4.8×10-11。回答下列问题:常温时0.1mol/L的Na2CO3溶液中CO32-的水解常数(忽略第二步水解)Kh=
,c(OH-)=
。
[c(H+)、c(F-)、c(HF)为HF在水溶液中达电离平衡时的浓度]。同样,弱酸盐和弱碱盐的水解程度也可用水解常数(Kh)表示,其计算方法和电离常数一样。资料表明,H2CO3在水中分两步电离,常温时的电离常数分别为K1=4.3×10-7,K2=4.8×10-11。回答下列问题:常温时0.1mol/L的Na2CO3溶液中CO32-的水解常数(忽略第二步水解)Kh=
,c(OH-)=
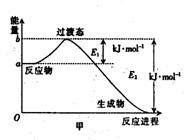
。

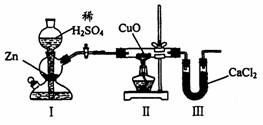 A.I、Ⅱ装置之间缺少干燥装置
A.I、Ⅱ装置之间缺少干燥装置