19.(8分) 元素周期表是20世纪科学技术发展的重要理论依据之一。
已知A、B、C、D、E五种元素都是元素周期表中前20号元素。A、B、C、D四种元素在课本元素周期表中的相对位置如下图所示,B、C、D的最高价氧化物的水化物两两混合,均能发生反应生成盐和水。E元素原子序数均大于A、B、C、D元素,且不与A、B、C、D元素位于同主族。
|
|
|
|
|
…… |
|
A |
|
|
|
B |
|
C |
D |
|
|
根据以上信息,回答下列问题:
(1)元素C在元素周期表中的位置是 ▲ 周期 ▲ 族。
(2)A和D的氢化物中,沸点较低的是 ▲ (填“A”或“D”);A和B的离子中,半径较小的是 ▲ (填离子符号)。
 (3)A和E可组成离子化合物,其晶胞(在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子位于该正方体的顶点或面心;阴离子均位于小正方体中心。该化合物的电子式为 ▲ 。
(3)A和E可组成离子化合物,其晶胞(在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子位于该正方体的顶点或面心;阴离子均位于小正方体中心。该化合物的电子式为 ▲ 。
 在弱酸性条件下,Cu2+与I-作用可生成I2,并被还原成白色的碘化亚铜沉淀;I2溶于过量的KI溶液中:I2+I- I3-,可用Na2S2O3标准溶液滴定,其反应为:2S2O32-+I3-=
S4O62-+3I-。
在弱酸性条件下,Cu2+与I-作用可生成I2,并被还原成白色的碘化亚铜沉淀;I2溶于过量的KI溶液中:I2+I- I3-,可用Na2S2O3标准溶液滴定,其反应为:2S2O32-+I3-=
S4O62-+3I-。 cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)一时间(t)图象如右图。则下列说法中正确的是
cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)一时间(t)图象如右图。则下列说法中正确的是  A.若a+b=c,则t0时只能是增大了容器的压强
A.若a+b=c,则t0时只能是增大了容器的压强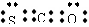 A.羰基硫属于非极性分子
A.羰基硫属于非极性分子