25(8分)下图是200 mg MnC2O4·2H2O晶体放在坩埚里加热分解时,所得固体产物的质量(m)随温度(t)变化的关系曲线。(已知草酸锰不稳定,但其中锰元素的化合价在300oC以下不变)
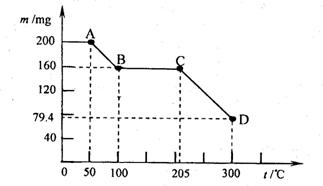
试回答下列问题:
(1)写出B点固体产物的化学式 ;
(2)从B点到C点过程中固体物质质量不变的原因是 。
(3)通过计算确定D点处产物的相对分子质量,并推断其合理的化学式。
26(11分)取一定质量的Fe 、Cu 混合物的粉末平均分成四等份,分别加入不同体积但同浓度的稀硝酸,实验中收集到的NO气体的体积及剩余固体的质量均记录在下表中(气体体积均在标准状况下测定)。
|
实验序号 |
① |
② |
③ |
④ |
|
稀硝酸体积 |
100mL |
200mL |
|
400mL |
|
剩余固体质量 |
17.2g |
8.00g |
固体恰好 全部溶解 |
0 |
|
气体体积 |
2.24L |
4.48L |
|
|
求:(1)计算稀硝酸的物质的量浓度;
23.(8分)下表是三个不同短周期部分元素的原子半径及主要化合价:
|
元素代号 |
W |
R |
X |
Y |
Z |
|
原子半径/nm |
0.037 |
0.157 |
0.066 |
0.070 |
0.077 |
|
主要化合价 |
+1 |
+1 |
-2 |
-3,+5 |
+2、+4 |
试回答下列问题:
⑴五种元素中原子半径最大的元素在周期表中位于 。
⑵写出下列有关反应的化学方程式:
①Z的单质与Y元素的最高价氧化物对应的水化物反应:
;
②R2X2与ZX2反应:
。
⑶X可与Z形成一种有恶臭味的气体,该气体与氧气发生反应的物质的量之比为1:2,且反应前后气体的总体积不变,试写出该气体分子(分子中各原子最外层均满足8e-结构,且含有非极性键)的电子式 。
19.(15分)(1)指出在使用下列仪器(已净)或用品的第一步操作:
|
石蕊试纸检验气体 |
容量瓶 |
集气瓶收集氯化氢 |
|
|
|
|
(2)下面是中学化学实验常见的几种定量仪器:A.量筒 B.容量 C.滴定管 D.托盘天平 E.温度计 F.球形移液管,其中
|
标出仪器使用温度的是 |
标有0刻度,且0刻度在上方的是 |
能够用以精确量取液体体积的是 |
使用A、C时由于俯视读数,使得到的数据比正确数据偏小的是 |
|
|
|
|
|
(3)配制一定物质的量浓度为0.2mol/LNaOH溶液500mL,填空并请回答下列问题:
|
应称量NaOH的质量 |
应选用容量瓶的规格 |
除容量瓶外还需要的其它仪器 |
|
g |
m |
|
用托盘天平称取固体样品时(1g 以下使用游码),若将样品放在了天平的右盘,读数为10.5g,则所称样品的实际质量为 g。
下列操作对配制的NaOH溶液浓度有偏高影响的是 。
A.称量时将NaOH固体直接放在天平托盘上面的纸上
B.将称量的NaOH固体置露在空气的时间过长
C.选用的容量瓶内有少量的蒸馏水
D.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
E.整个配制过程中容量瓶不振荡
14.气态中性原子失去一个电子转化为气态正离子所需要的最低能量叫做第一电离能(I1),气态正离子继续失去电子所需最低能量依次称为第二电离能(I2)、第三电离能(I3)……下表是第三周期部分元素的电离能[单位:eV(电子伏特)]数据。
|
元素 |
I1/eV |
I2/eV |
I3/eV |
|
甲 |
5.7 |
47.4 |
71.8 |
|
乙 |
7.7 |
15.1 |
80.3 |
|
丙 |
13.0 |
23.9 |
40.0 |
|
丁 |
15.7 |
27.6 |
40.7 |
下列说法正确的是
A.甲的金属性比乙强 B.乙的化合价为+1价
C.丙可能为非金属元素 D.丁一定是金属元素
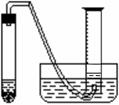 ⑷测量收集到气体体积(图中夹持仪器已省略)时,如何使量筒内外液面的高度相同?_____________________________。
⑷测量收集到气体体积(图中夹持仪器已省略)时,如何使量筒内外液面的高度相同?_____________________________。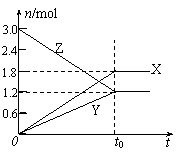

 A.该反应的化学方程式为:3X+2Y 2Z
A.该反应的化学方程式为:3X+2Y 2Z