19、(12分)现有下列短周期元素性质的数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径(10-10m) |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
1.43 |
|
最高或最低化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
–2 |
|
|
–3 |
–1 |
|
–3 |
|
试回答下列问题:
(1)上述元素中处于第VA族的有 ,处于第二周期的有 (以上均用编号表示)。
(2)上述元素中金属性最强的是 (用编号表示)。
(3) 写出元素①、⑧形成的化合物与KOH溶液反应的化学方程式 。
元素①、⑥能形成两种化合物,写出其中较稳定的化合物与水反应的化学方程式:
。
(4)经验表明,除氢和氦外,当元素原子的电子层数(n)多于或等于原子最外层电子数
(m)即(n–m)≥ 0时,该元素属于金属元素;当元素原子的最外层电子数(m)多于原子的电子层数(n)即(n–m)< 0时,该元素属于非金属元素。试回答:
a.第n(n≥ 2)周期有 种非金属元素(含零族元素)。
b.根据周期表中每个周期非金属元素的种数,预测周期表中应有 种非金属元素(含零族元素)。还有 种未发现,未发现的非金属处在第 周期第 族(注:将零族看作VIIIA族)。
甲:将锌放入浓盐酸中,反应速率较快
乙:将实验过程记录下来,并交流。

根据上述资料与交流材料回答下列列问题
⑴乙反应速率明显比甲快,原因是: 。
⑵丙、丁根据铜位于金属活动顺序表氢之后,与盐酸不反应,对乙产生的气体体积比甲大的事实。作出如下推断:
①丙认为是溶解在溶液中的H2逸出,你认为是否有道理,理由是: 。
②丁作了如下猜想,是否成立,请你设计实验方案。
|
丁猜想 |
验证方法 |
预测现象及结论 |
|
丁认为铜片中可能含有锌等杂质 |
|
|
⑶戊注意到乙中(3)中的白色沉淀,分析:不可能是CuCl2,因为CuCl2溶液显蓝色或绿色,也不可能是氯化锌,因为稀释后溶液更稀,不会析出。并利用资料①②大胆猜想,白色沉淀是生成的氯化亚铜。请你帮他设计验证方案(若有多个只设计两个方案):
|
戊 |
预计验证方法 |
预测的现象与结论 |
|
白色沉淀是氯化亚铜 |
|
|
|
|
|
⑷指导老师肯定了戊的猜想,请结合资料③,写出铜与足量浓盐酸在加热条件下反应生成无色溶液及气体,化学方程式可能是: 。
乙的实验步骤(3)稀释,生成沉淀,实际上是一个平衡问题,请写出这一平衡关系:
(用离子方程式表示)。
⑸就铜与浓盐酸反应若进一步探讨,你认为下一步实验方案: 。
 3C(g) +
D(s),反应达到平衡时C的浓度为1.2 mol/L。
3C(g) +
D(s),反应达到平衡时C的浓度为1.2 mol/L。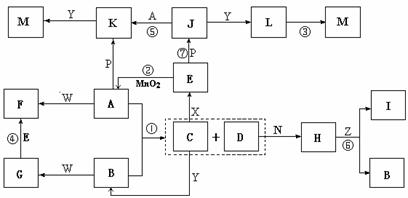
 甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO-ZnO/γ- Al2O3催化剂,合成反应为:CO+2H2
CH3OH,工艺中一些参数如右
甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO-ZnO/γ- Al2O3催化剂,合成反应为:CO+2H2
CH3OH,工艺中一些参数如右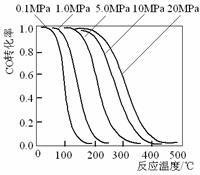 下列关于新法和旧法的说法正确的是
下列关于新法和旧法的说法正确的是