(五)无机化合物的分类
1. 按组成、性质分类
 金属氢化物
金属氢化物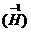 如NaH
如NaH
|
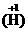 如HCl
如HCl
 组成 金属氧化物
组成 金属氧化物

 非金属氧化物
非金属氧化物
|
 碱性
碱性
 性质 成盐氧化物 酸性
性质 成盐氧化物 酸性
两性
 不成盐氧化物 如NO, CO, NO2
不成盐氧化物 如NO, CO, NO2
特殊氧化物 如Na2O2, KO2, Fe3O4
 是否含氧 含氧酸
如 HClO4
是否含氧 含氧酸
如 HClO4

 无氧酸 如HCl
无氧酸 如HCl
 电离出H+量 一元酸
如HNO3,HI
电离出H+量 一元酸
如HNO3,HI
 多元酸 如H3PO4, H2C2O4
多元酸 如H3PO4, H2C2O4
 酸根性质 氧化性酸
如浓H2SO4, HNO3, HMnO4
酸根性质 氧化性酸
如浓H2SO4, HNO3, HMnO4
 还原性酸
如HI, H2S
还原性酸
如HI, H2S
|
 电离程度 强酸
如HCl, H2SO4
电离程度 强酸
如HCl, H2SO4
 弱酸 如H2S. CH3COOH
弱酸 如H2S. CH3COOH
 挥发性 难挥发酸 如H3PO4,
H2SO4
挥发性 难挥发酸 如H3PO4,
H2SO4
 易挥发酸 如浓HCl, 浓HNO3
易挥发酸 如浓HCl, 浓HNO3
 稳定性 稳定性酸 如HCl, H2SO4,
H3PO4
稳定性 稳定性酸 如HCl, H2SO4,
H3PO4
 不稳定性酸 如HNO3, HI, H2S, H2SO3
不稳定性酸 如HNO3, HI, H2S, H2SO3
 电离出OH-数 一元碱 NaOH, NH3·H2O
电离出OH-数 一元碱 NaOH, NH3·H2O
 多元碱Ba(OH)2, Mg(OH)2
多元碱Ba(OH)2, Mg(OH)2
|
 溶解性 可溶性碱 如NaOH, NH3·H2O
溶解性 可溶性碱 如NaOH, NH3·H2O
 难溶性碱 如Mg(OH)2, Fe(OH)3
难溶性碱 如Mg(OH)2, Fe(OH)3
 电离程度 强碱
如 KOH
电离程度 强碱
如 KOH
 弱碱
如NH3·H2O
弱碱
如NH3·H2O
 正 盐 如 K2SO4
正 盐 如 K2SO4
|
碱式盐 如 Cu2(OH)2CO3
复 盐 如 KAl(SO4)2·12H2O
络 盐 如 Na3AlF6
想一想:复盐和络盐有何区别?(提示:根据能否电离出络合离子。)
2. 按微粒间成键种类分
 共价化合物: 如 CO2, SiO2
共价化合物: 如 CO2, SiO2
化合物
离子化合物 如 NaCl, NH4Cl
3.按能否电离来分
 电解质 电离 强电解质
电解质 电离 强电解质
 化合物
程度 弱电解质
化合物
程度 弱电解质
非电解质
(四)比较“四同”
|
名称 内容 |
同位素 |
同素异形体 |
同系物 |
同分异构体 |
|
相同点 |
质子数 |
元素 |
结构相似官能团种类和个数 |
化学式 |
|
不同点 |
中子数 |
分子构成或晶体结构 |
分子组成相差(CH2)n |
分子结构 |
|
对象 |
原子 |
单质 |
有机物 |
有机物 |
|
物性 |
不同 |
不同 |
不同 |
不同 |
|
化性 |
几乎相同 |
相似 |
相似 |
相似或不同 |
|
实例 |
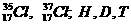 D. T D. T |
O2、O3;红磷,白磷;金刚石,石墨 |
乙烯,丙烯;甲苯,乙苯 |
乙醇,甲醚;甘氨酸,硝基乙烷 |

(三)判别混合物和纯净物
首先抓住基本特征,列表比较如下:
|
纯净物 |
混合物 |
|
①有固定的组成和结构 ②有一定的熔、沸点 ③保持一种物质的性质 |
无固定组成和结构 无一定的熔、沸点 保持原有物质各自的化学性质 |
其次,要熟悉一些常见的混合物的名称、组分等
最后,对一些物质混合在一起,要注意有无反应的可能性(是否具备反应条件)、反应的完全性(反应若为可逆,一定得到的是混合物)、反应物间得投料比等诸多情况。
(二)物质的构成微粒
如何判断一种物质是由何种微粒构成?
先看一个实例 :
下列均由分子构成的一组物质是( )
A. CH4, H2O, SiO2 B. CS2, O2, Cl2
C. P, C, SiH4 D. C2H4, H3PO4, NaCl
要解答此类问题,首先必须弄清每种化学式所指物质的晶体类型,以及每种微粒能构成物质的常见类别,现列表如下:
|
晶体类型 |
构成微粒 |
常见物质类别 |
实 例 |
|
原子晶体 |
原子 |
少数非金属单质、某些非金属氧化物 |
金刚石 Si, SiO2 |
|
分子晶体 |
分子 |
某些非金属单质、气态氢化物和氧化物、酸、有机物 |
H2, O2, HCl, H2O, SO2, SO3, C2H4, C2H5OH |
|
离子晶体 |
阴、阳离子 |
大多数盐(含铵盐)、强碱、大多数金属氧化物、金属氢化物 |
NaCl,NH4NO3 、NaOH, MgO、Na2O2、NaH等 |
由表可进一步找出下列关系
微粒 形成的物质种类
 离子
单
质
离子
单
质
原子
 分子
化合物
分子
化合物
如掌握以上知识,再看例题,则不难选出正确答案为B
24.金属X和非金属Y可直接化合生成化合物XY,甲、乙、丙三人分别做X和Y的化合实验,充分反应时每人所用X和Y的质量各不相同,但总质量均为10g.有关实验数据如下表:
|
|
X用量 |
Y用量 |
得XY量 |
|
甲 |
8g |
2g |
8g |
|
乙 |
6g |
4g |
8g |
(1)利用表中数据判断X和Y反应时,X和Y的质量比为___________
(2)若丙同学在实验中得到6gXY,则丙同学X和Y的用量分别是_________、________
 元素--宏观概念, 只论种类不论个数
元素--宏观概念, 只论种类不论个数 元素--由核电荷数(即质子数)决定
元素--由核电荷数(即质子数)决定

 和H2O+(常写成H+)相当,NH
和H2O+(常写成H+)相当,NH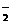 和OH-相当,NH2-(有时还包括N3-)和O2-相当,已知在液氨中酸发生下列两个反应:
和OH-相当,NH2-(有时还包括N3-)和O2-相当,已知在液氨中酸发生下列两个反应: