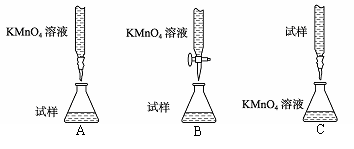
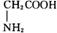11.下表选项中对规定反应的离子方程式的评价合理的是 ( )
|
选项 |
反应 |
离子方程式 |
评价 |
|
A |
FeI2和Cl2以5:7的物质的量比反应 |
4Fe2++10I一+7Cl2=4Fe3++5I2+14CI一 |
正确 |
|
B |
碳酸氢钠溶液与足量 的氢氧化钡溶液反应 |
Ba2++20H一+2HC03=BaC03↓+C032-+2H20 |
正确 |
|
C |
金属Na和CuS04溶 液反应 |
Na+Cu2+=Na++Cu |
错误。离子方程式不 符合电荷守恒原则 |
|
D |
过量二氧化碳通入次 氯酸钙溶液中反应 |
2C10一+H20+C02=2HCl0+CO32- |
错误。生成物碳酸钙 不应写成离子形式 |
20.A(12分)第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物。
(1)下列叙述正确的是 。(填字母)
A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个 键和1个大
键和1个大 键,C6H6是非极性分子
键,C6H6是非极性分子
 D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
|
元 素 |
Mn |
Fe |
|
|
电离能 /kJ·mol-1 |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
Mn元素价电子排布式为 ▲ ,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 ▲ 。
(3)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于 ▲ 区。
(4)Ti的一种氧化物X,其晶胞结构如上图所示,则X的化学式为 ▲ 。
(5)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2。
① H、C、N、O四种元素的电负性由小到大的顺序为 ▲ 。
② 与CNO-互为等电子体微粒的化学式为 ▲ (写出一种即可)。
③ 氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 ▲ 。
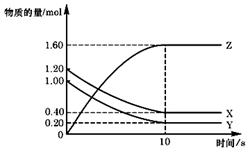 T ℃时,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,
T ℃时,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,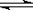 2Z(g),平衡常数K= 40
2Z(g),平衡常数K= 40 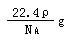 用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
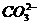 ③
③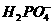 ④NH3 ⑤H2S
⑥CH3COOH
④NH3 ⑤H2S
⑥CH3COOH
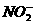 ⑩
⑩