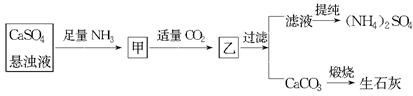
摘要:19.某工厂用CaSO4.NH3.H2O.CO2制备(NH4)2SO4.其工艺流程如下: 已知:Ksp(CaCO3)=2.8×10―9 .硫酸钙悬浊液中CaSO4136kg•m―3.生产过程中CO2的利用率为90%.并测得滤液中c(CO32―)为0.001 mol•L―1. (1)甲中通入CO2后发生反应的方程式为: ▲ . (2)求Ksp(CaSO4) = ▲ . (3)若每天用1000 m3的悬浊液.试计算: ① 可生产纯度为95%的(NH4)2SO4多少吨? ② 还需要补充含90%CaCO3的大理石多少吨?
网址:http://m.1010jiajiao.com/timu3_id_328081[举报]
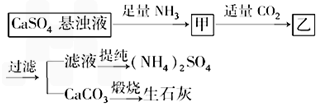
某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:下列推断不合理的是( )
A.往甲中通CO2有利于(NH4)2SO4生成
B.生成1 mol(NH4)2SO4至少消耗2 mol NH3
C.CO2可被循环使用
D.直接蒸干滤液能得到纯净的(NH4)2SO4
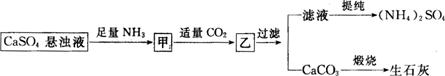
查看习题详情和答案>>某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
下列推断不合理的是
A.往甲中通适量CO2有利于(NH4)2SO4生成
B.生成1mol(NH4)2SO4至少消耗2 NH3
C.CO2可被循环使用
D.直接蒸干滤液能得到纯净的(NH4)2SO4
查看习题详情和答案>>
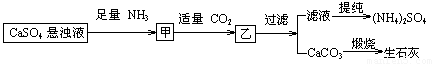
某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如图所示,下列推断不合理的是( )
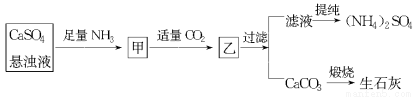
A.直接蒸干滤液得到纯净的(NH4)2SO4
B.生成1 mol(NH4)2SO4至少消耗2 mol NH3
C.CO2可被循环使用
D.往甲中通入CO2有利于(NH4)2SO4生成
查看习题详情和答案>>