30.(15分)X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
|
元素 |
相关信息 |
|
X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
|
Y |
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
|
Z |
Z和Y同周期,Z的电负性大于Y |
|
W |
W的一种核素的质量数为63,中子数为34 |
(1)XY2是一种常用的溶剂,XY2的分子中存在 个σ键。YZ2分子中中心原子的价层电子对数为 。
(2)在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(3)W的基态原子核外电子排布式是 ,向含有W2+的溶液中逐滴加入过量的氨水,现象为 ,相应的离子方程式为 、 。
(4)相同条件下XO2与YO2分子在水中溶解度较大是 ,理由是
。
(5)请设计一个实验方案,比较Y、Z单质氧化性的强弱:
________________________________________________________________________________________________________________________________________。

29.(11分)下表为元素周期表的一部分,a、b、c…为部分元素。回答下列问题:
K^S*5U.C#O%
|
a |
|
|
|||||||||||||||
|
|
|
|
|
f |
y |
h |
i |
|
|||||||||
|
|
b |
|
e |
|
|
|
j |
|
|||||||||
|
c |
|
|
|
|
|
|
d |
[ |
d |
|
g |
|
l |
|
|
|
|
|
|
|
|
[ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)请写出h元素的价电子排布图 ;
(2)ya3分子的电子式是 ,其分子的空间构型是 ,分子中y原子的杂化轨道类型是 , g2+可以与ya3 以 键形成 [g (ya3)4]2+离子;
(3)请写出上述元素d3+的核外电子排布式 ,实验室常用形成一种红色配离子的方法检验该离子,该反应的离子方程式为
。
(4)请比较b、e、j三种元素的第一电离能由大到小的顺序 (写元素符号),其原因是
24.已知X、Y是主族元素,下表中I为电离能,单位是kJ/mol。下列判断错误的是
|
元素 |
I1 |
I2 |
I3 |
I4 |
|
X |
500 |
4600 |
6900 |
9500 |
|
Y |
580 |
1800 |
2700 |
11600 |
A.元素X的常见化合价是+1价 B.元素Y是ⅢA族的元素
 C.元素X与氯形成化合物时,化学式可能是XCl
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第3周期,它可与冷水剧烈反应
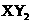 型化合物,则X与Y 的原子序数之差可能为2或5
型化合物,则X与Y 的原子序数之差可能为2或5