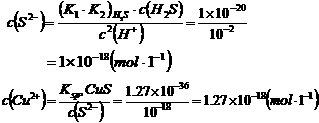0 32319 32327 32333 32337 32343 32345 32349 32355 32357 32363 32369 32373 32375 32379 32385 32387 32393 32397 32399 32403 32405 32409 32411 32413 32414 32415 32417 32418 32419 32421 32423 32427 32429 32433 32435 32439 32445 32447 32453 32457 32459 32463 32469 32475 32477 32483 32487 32489 32495 32499 32505 32513 447348
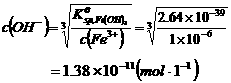
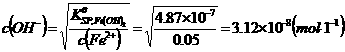
 CuS+2H+
CuS+2H+