摘要:29.下表为元素周期表的一部分.a.b.c-为部分元素.回答下列问题: K^S*5U.C#O% a f y h i b e j c d [ d g l [ (1)请写出h元素的价电子排布图 , (2)ya3分子的电子式是 .其分子的空间构型是 .分子中y原子的杂化轨道类型是 . g2+可以与ya3 以 键形成 [g (ya3)4]2+离子, (3)请写出上述元素d3+的核外电子排布式 .实验室常用形成一种红色配离子的方法检验该离子.该反应的离子方程式为 . (4)请比较b.e.j三种元素的第一电离能由大到小的顺序 .其原因是
网址:http://m.1010jiajiao.com/timu3_id_324998[举报]
下表为元素周期表的一部分,a、b、c…为部分元素.回答下列问题:
(1)请写出h元素的价电子排布图
 ;
;
(2)ya3分子的电子式是
 ,其分子的空间构型是
,其分子的空间构型是
(3)请写出上述元素d3+的核外电子排布式
(4)请比较b、e、j三种元素的第一电离能由大到小的顺序
查看习题详情和答案>>
| a | |||||||||||||||||
| f | y | h | i | ||||||||||||||
| b | e | j | |||||||||||||||
| c | d | g | l | ||||||||||||||


(2)ya3分子的电子式是


三角锥形
三角锥形
,分子中y原子的杂化轨道类型是sp3杂化
sp3杂化
,g2+可以与ya3 以配位
配位
键形成[g(ya3)4]2+离子;(3)请写出上述元素d3+的核外电子排布式
ls22s22p63s23p63d5
ls22s22p63s23p63d5
,实验室常用形成一种红色配离子的方法检验该离子,该反应的离子方程式为Fe3++3SCN-=Fe(SCN)3
Fe3++3SCN-=Fe(SCN)3
.(4)请比较b、e、j三种元素的第一电离能由大到小的顺序
Cl>Mg>Al
Cl>Mg>Al
(写元素符号),其原因是同一周期,随着原子序数的增加,元素的第一电离能呈现增大的趋势.但镁元素的最外层电子达到全充满的稳定结构,其第一电离能大于铝元素
同一周期,随着原子序数的增加,元素的第一电离能呈现增大的趋势.但镁元素的最外层电子达到全充满的稳定结构,其第一电离能大于铝元素
.下表为元素周期表的一部分,a、b、c…为部分元素.回答下列问题:
(1)请写出上述元素d3+的核外电子排布式
(2)请写出e元素的原子电子轨道表示式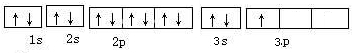
 ;
;
(3)ya3分子的电子式是
 ,其分子的空间构型是
,其分子的空间构型是
(4)b、e两种元素中,金属性较强的是
(5)h的i形成hi2分子杂化类型是
查看习题详情和答案>>
| a | |||||||||||||||||
| f | y | h | i | ||||||||||||||
| b | e | j | |||||||||||||||
| c | d | d | g | l | |||||||||||||
1s222s2p63s23p63d5
1s222s2p63s23p63d5
;(2)请写出e元素的原子电子轨道表示式


(3)ya3分子的电子式是


三角锥形
三角锥形
,(4)b、e两种元素中,金属性较强的是
Mg
Mg
;第一电离能大的是Mg
Mg
.(填元素符号)(5)h的i形成hi2分子杂化类型是
sp3
sp3
fh32-的空间构型分别为平面正三角形
平面正三角形
.下表为元素周期表的一部分,a、b、c…为部分元素.回答下列问题:
(1)请写出上述元素d3+的核外电子排布式
(2)请比较y、h、i三种元素的第一电离能由大到小的顺序
(3)请写出e元素的原子价电子排布图
 ;
;
(4)ya3分子的电子式是
 ,其分子的空间构型是
,其分子的空间构型是
(5)b、e两种元素中,金属性较强的是
查看习题详情和答案>>
| a | |||||||||||||||||
| f | y | h | i | ||||||||||||||
| b | e | j | |||||||||||||||
| c | d | g | l | ||||||||||||||
1s222s2p63s23p63d5
1s222s2p63s23p63d5
;(2)请比较y、h、i三种元素的第一电离能由大到小的顺序
F>N>O
F>N>O
(写元素符号),其原因是同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,但N元素2p电子达到半充满的稳定构型,所以其第一电离能大于O元素
同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,但N元素2p电子达到半充满的稳定构型,所以其第一电离能大于O元素
.(3)请写出e元素的原子价电子排布图


(4)ya3分子的电子式是


三角锥
三角锥
,分子中y原子的原子轨道的杂化类型是sp3
sp3
.(5)b、e两种元素中,金属性较强的是
Mg
Mg
(填元素符号),写出能证明这一结论的一个实验事实氢氧化镁碱性大于氢氧化铝
氢氧化镁碱性大于氢氧化铝
.下表为元素周期表的一部分,a、b、c…为部分元素.回答下列问题:
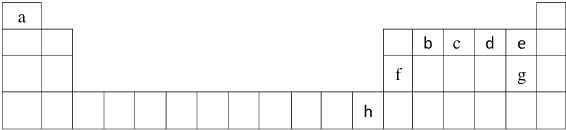
(1)请写出上述元素h的基态原子核外电子排布式 ;
(2)比较e、g两种元素的气态氢化物的稳定性 (写化学式);
(3)b2a4分子的结构式是 ,该分子中存在的σ键与π键的个数比为 ;
(4)c、d两种元素中第一电离能较大的是 (写元素符号),其原因是 ;
(5)已知f的氢氧化物与水电离出的OH-可形成配位键,则生成的含有配位键的离子的结构简式为 (标出配位键).
查看习题详情和答案>>

(1)请写出上述元素h的基态原子核外电子排布式
(2)比较e、g两种元素的气态氢化物的稳定性
(3)b2a4分子的结构式是
(4)c、d两种元素中第一电离能较大的是
(5)已知f的氢氧化物与水电离出的OH-可形成配位键,则生成的含有配位键的离子的结构简式为
(13分)下表为元素周期表的一部分,a、b、c…为部分元素。回答下列问题:
| a |
|
| |||||||||||||||
|
|
|
|
| f | y[ | h | i |
| |||||||||
|
| b |
| e |
|
|
| j |
| |||||||||
| c |
|
|
|
|
|
| d |
| d |
| g |
| l |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)请写出上述元素g的核外电子排布式 ;
(2)请比较b、e两种元素的第一电离能 (写元素符号),其原因是
(3)试比较i、j两种元素的气态氢化物的稳定性 (写化学式)
(4)f2a4分子的结构式是 ,该分子中存在的σ键与π键的个数比为
查看习题详情和答案>>