1.认识氧气的性质
(1)氧气的物理性质
通常状况下,氧气是一种__________、__________的气体,密度稍__________空气,氧气__________溶于水,通常状况下,1 L水中能溶解30 mL氧气。
氧气有三态变化,在加压降温时,氧气可变成__________色的液体,甚至可变成雪花状__________色的固体。
(2)氧气的化学性质
|
反应物 |
在氧气中的燃烧现象 |
反应表达式 |
|
木炭(灰黑色固体) |
①在空气中燃烧发出红光。②在氧气中燃烧发出________。③放出________。④生成的气体能使________ |
碳+氧气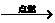 ________ ________C+O2 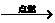 CO2 CO2 |
|
硫(淡黄色固体) |
①在空气中燃烧发出________。②在氧气中燃烧发出明亮的________。③放出________。④生成有________气味的气体 |
硫+氧气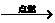 ________ ________S+O2 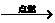 ________SO2 ________SO2 |
|
磷(暗红色) |
①红磷燃烧产生浓厚________。②在空气中燃烧产生黄色光。③在氧气中燃烧发出耀眼的________。④放出________ |
磷+氧气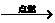 P+O2 P+O2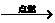 P2O5 P2O5 |
|
铁(银白色) |
①剧烈燃烧。②________。③放出________。④生成________ |
铁+氧气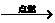 ________ ________Fe+O2 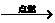 Fe3O4 Fe3O4 |
|
蜡烛(白色固体) |
①火焰明亮,发出________。②放出________。③瓶壁上有________出现。④生成能使________的气体 |
石蜡+氧气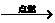 ________+________ |
小结:氧气是一种化学性质比较__________的气体,许多物质可与氧气发生反应。在某些条件下,物质与氧气的反应比较剧烈;而在另一些条件下,物质与氧气发生缓慢的氧化反应,如动植物的新陈代谢、金属器皿的锈蚀、食物的腐烂、有机肥的腐熟等变化过程都包含有__________作用。
答案:(1)无色 无味 大于 不易 淡蓝 淡蓝
(2)白光 热量 澄清石灰水变浑浊 二氧化碳
微弱的淡蓝色火焰 蓝色火焰 热量 刺激性 二氧化硫
白烟 白光 热量 五氧化二磷
白光 热量 白色固体 三氧化二铝(氧化铝)
火星四射 热量 黑色固体 四氧化三铁
明亮白光 热量 水珠 澄清石灰水变浑浊 二氧化碳 水
活泼 缓慢氧化
2.为什么烧水的水壶内时间长了会有水垢?
剖析:因为水中含有可溶性的钙、镁化合物,在烧水的过程中,温度升高,发生化学变化,形成不溶性的物质,即形成了水垢。
问题探究
问题1 家中的水壶使用较长一段时间后,在壶底会结上一层厚厚的水垢(它的主要成分是碳酸钙与氢氧化镁,能溶于酸)。试利用家中现有的物质和用品设计一个实验来除去铝壶中的水垢。
探究:水垢能溶于酸,家中常见的酸,就是醋酸。先用机械刮擦的方法除去壶帮和壶嘴里比较松软的水垢,这样可以减少食醋的用量,然后把食醋倒入壶里。为了加快反应,还应该把水壶加热,温度维持在60-70℃。这样,水垢就可以慢慢变得疏松,容易去除。
问题2 设计实验区分蒸馏水和自来水。
探究:取这两种水各少许放于两个烧杯中,加热蒸发至完全没有,观察烧杯底部,如果出现少量的固体物质则是自来水,另一种水则为蒸馏水。
典题精讲
例1 在日常生活中,有人喜欢喝纯净水,市售纯净水中有一些是蒸馏水,有关这类纯净水的下列说法中,正确的是( )
A.它是纯天然饮品,不含任何化学物质
B.它是一种硬水
C.它在通电条件下不能分解成氢气和氧气
D.它纯净、清洁,但不宜长期饮用
思路解析:蒸馏水是纯水,不含矿物离子和微量元素,不适合饮用;但它是化合物,本身就是化学物质,不能说不含化学物质;通电时能够电解,生成氢气和氧气,但电解很慢;它洁净,是纯水,但不适合做饮用水水源。
答案:D
例2 通电分解水的简易装置如图3-11所示。
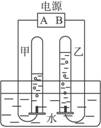
图3-11
(1)在水中加入少量硫酸或氢氧化钠的目的是为了_______________________________。
(2)试管甲中生成的是_______气,则B极为_______极(填“正”或“负”),甲、乙两试管内气体的质量比为_______。
(3)电解水的实验说明水是由_______组成的。这个实验还验证了在化学反应里_______,可以分成原子,而_______不能再分。
思路解析:由于纯水的导电性能很差,应该加入酸或碱增强水的导电性,使电解加快。水电解生成氢气和氧气,说明水是由氢元素和氧元素组成的。电解过程把水分子变成氢、氧原子,说明原子是化学变化中的最小粒子。
答案:(1)增强水的导电性,加快电解速度
(2)氢 正 1∶8
(3)氢、氧 分子可以再分 原子
知识导学
在压强为101 kPa时,水加热到100 ℃就烧开了。冬天,到了0 ℃就要结冰。冰浮在水面上。
利用明矾等絮凝剂溶于水后,生成的胶状物对杂质进行吸附,使杂质沉降来达到净水的目的。
过滤时要注意:
过滤是分离混合物的一种常用的方法。若两种物质混合,需进行过滤分离,则必须符合一种可溶,一种不溶。过滤时一定严格按照“一贴”“二低”“三靠”进行操作。否则,容易导致实验失败。
几种水净化方法的比较:
|
水的净化方法 |
除去不溶性杂质 |
除去可溶性杂质 |
降低水的硬度 |
|
静置沉淀 |
可以 |
否 |
|
|
过滤 |
可以 |
否 |
|
|
吸附 |
可以 |
可以 |
|
|
蒸馏 |
可以 |
可以 |
可以 |
蒸馏操作时要注意的要点:
①在烧瓶中加入约1/3体积的硬水,再加入少量防暴沸沸石或碎瓷片。
②蒸馏时注意保持温度缓慢上升,同时通入冷水进行冷却。
③当蒸馏烧瓶中只有少量液体或已达到规定要求时即停止蒸馏。
人们长期饮用硬水有害人体的健康。
水垢形成的原理:
人们在煮沸硬水的过程中,可以看到形成水垢,水垢的形成主要是因为原来可溶性的钙、镁化合物经过加热后,形成了不溶性的化合物。水垢的主要成分是碳酸钙和氢氧化镁。
蒸馏水是净化程度较高的水。
疑难导析
需说明水中的杂质有哪些,无色透明的水是否一定不含可溶性杂质,可溶性杂质是否一定对人体健康有利。
要说明水中含有什么物质,这些物质在加热时会发生什么变化,生成什么物质。
问题导思
要先知道水垢的成分,在家中什么物质能与之反应。
为了减少酸的用量,先用什么办法除垢,要说明水中含有什么物质,这些物质在加热时会发生什么变化,对反应有何影响,生成什么物质,水垢怎样变化,是否容易除去。
先要知道蒸馏水是否是纯度较高的水,有无不溶性杂质,有无可溶性杂质。自来水中有无不溶性杂质,有无可溶性杂质,然后把水蒸发除去,可溶性杂质亦即可暴露出来。根据蒸馏水和自来水的现象不同即可判断。
典题导考
绿色通道
物质的外观与物质的本质有很大的差距,我们不能凭视觉效果判断物质的组成或推测物质的性质,必须利用实验分析物质的组成。
典题变式
下列说法正确的是( )
A污水只是看起来脏点,其实没有害处
B.水厂的水源不需要选择
C.污水里有病菌
D.农村空气好,没有污水
答案:C
绿色通道
电解过程增强导电性的方法是加入电解质;加入的一般是硫酸或氢氧化钠。不要以为加入任意酸、碱都可以,有的酸会对电解产生影响。
典题变式
电解54 g水,可得到氢气( )
A.6 g B.3 g C.1.5 g D.8 g
答案:A
典题变式
电解水时常加入少量的稀硫酸或氢氧化钠溶液是因为( )
A.它们是水分解反应的催化剂
B.可以增强水的导电性
C.可以更多地生成氢气和氧气
D.可以用它们除掉水中的有害物质
答案:B

 四氧化三铁
四氧化三铁 Fe3O4
Fe3O4 SO2↑
D.4P+5O2
SO2↑
D.4P+5O2 ______Fe+______CO2
______Fe+______CO2 FeCl3
FeCl3