2.实验室制取二氧化碳气时,为什么加入稀盐酸要选择长颈漏斗而不用普通短颈漏斗?
剖析:因为普通漏斗颈太短,产生的二氧化碳气会从漏斗处逸出。长颈漏斗下端管口在液面下被液体封住,气体不会从长颈漏斗处逸出。
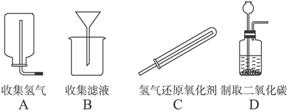
2.二氧化碳的制备与氢气制备的比较
|
|
反应物状态 |
反应条件 |
气体密度比空气的大或小 |
是否与水反应 |
收集方法 |
|
二氧化碳 |
固体+液体 |
常温常压下 |
大 |
能 |
向上排空气法 |
|
氢气 |
固体+液体 |
常温常压下 |
小 |
不 |
排水法 |
疑难突破
 B
B B
B D
D