3.(17分)实验室用浓盐酸、二氧化锰共热制氯气,并用氯气和Ca(OH)2制取少量漂白粉。现已知反应:2Cl2 + 2Ca(OH)2 = Ca(ClO)2 + CaCl2 + 2H2O是放热反应,温度稍高即发生副反应:6Cl2 + 6Ca(OH)2 = Ca(ClO3)2 + 5CaCl2 + 6H2O。现有3个同学各分别设计了1套实验装置如下图:
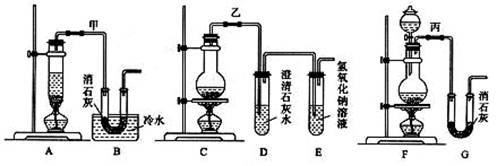
(1)写出实验室制取氯气的化学方程式________________________________________;
(2)检查丙装置气密性的方法 ________________________________________;
(3)请从以下几个方面对甲、乙、丙3套实验装置的优缺点作出评价,并将符合题目要求的选项的序号字母填在表中对应空格:
a.不容易控制反应速率 b.容易控制反应速率 c.有副反应发生
d.可防止副反应发生 e.污染环境 f.可防止污染环境
|
|
优 点 |
缺 点 |
|
甲装置 |
|
|
|
乙装置 |
|
|
|
丙装置 |
|
|
(4)上述装置中甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成,请从上述装置中选取合理的部分,组装一套较完整的实验装置,装置各部分连接顺序是________________________(按气流流动的方向)。该组合中还缺少____________________________________________的装置,原因是_____________
___________________________;
(5)实验室若用12mol/L的盐酸100mL与足量的二氧化锰反应,理论上最终生成次氯酸钙的物质的量最多不超过____________mol。
2.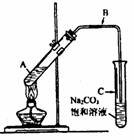 (15分)某兴趣小组利用右图装置,取不同浓度的硫酸与3mL无水乙醇
(15分)某兴趣小组利用右图装置,取不同浓度的硫酸与3mL无水乙醇
和2mL冰醋酸分别进行制取乙酸乙酯的研究。
(1)A 试管内生成乙酸乙酷的化学反应方程式为:
___________________________________________________
(2)导气管 B 的管口没有插入饱和碳酸钠液面以下,原因是
___________________________________________________
(3)兴趣小组记录的实验现象和结果如下表:
|
组序号 |
催化剂 |
反应现象 |
C中饱和碳酸钠溶液中酯层高度 |
|
① |
2mL98%浓硫酸 |
20秒时溶液出现棕色,随反应进行,溶液颜色逐步加深,最后成黑色;酯层无气泡 |
2.10cm |
|
② |
2mL14mol·L-1硫酸 |
反应后溶液呈浅棕色;酯层与饱和碳酸钠溶液界面清晰,没有气泡 |
2.14cm |
|
③ |
2mL10mol·L-1硫酸 |
反应后溶液呈无色;酯层与饱和碳酸钠溶液界面清晰,没有气泡 |
2.16cm |
|
④ |
2mL7mol·L-1硫酸 |
反应后溶液呈无色;酯层与饱和碳酸钠界面有气泡 |
2.00cm |
I.第 ① 组实验中,试管内溶液颜色随反应进行逐渐加深,最后变成黑色的原因是:
_______________________________________________________________________
若同时有刺激性气味的气体产生,则可能发生的化学反应方程式是:
___________________________________________________________。
II.试管 C 的酯层中没有乙酸的实验组是(填组序号)__________________;从实验结果分析,选用催化剂的最佳浓度是_______________________________。
Ⅲ.由实验结果可知,盐酸_______(填“能”或“不能”)作酯化反应的催化剂,其原因是________________________________________________________________。
24.在核磁共振氢谱中出现两组峰,其氢原子数之比为3∶2的化合物是 ( )
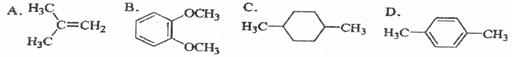
|
|
|
|
|
① ② ③ ④ ⑤
A:3种; B:4种; C:5种; D:6种。
 ,还含有
,还含有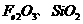 )
)
 L
L 的NaOH溶液480mL,配制该溶液已有下列仪器:托
的NaOH溶液480mL,配制该溶液已有下列仪器:托
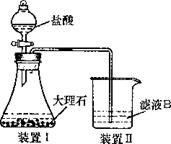 (2)写出步骤①中发生反应的离子方程式
。
(2)写出步骤①中发生反应的离子方程式
。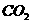 气体,并通人滤液B中制各
气体,并通人滤液B中制各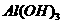 时,结果没有产生预期现象。
时,结果没有产生预期现象。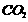 中含有HCl气体,也是导致实验失败的原因,在实验中增加某装置
中含有HCl气体,也是导致实验失败的原因,在实验中增加某装置 可解决这个问题。请帮助阿同学画出该装置图,并注明试剂名称。
可解决这个问题。请帮助阿同学画出该装置图,并注明试剂名称。

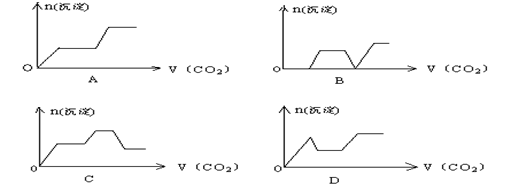 将足量的CO2不断通入KOH、Ca(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为 ( )
将足量的CO2不断通入KOH、Ca(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为 ( ) 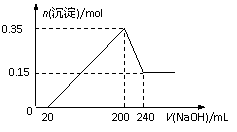 将一定质量的Mg和Al的混合物投入500 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,
将一定质量的Mg和Al的混合物投入500 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液, A.X元素可能为Al
A.X元素可能为Al