29.(16分)已知:以铜作催化剂,用空气氧化醇制取醛,事实上是空气先与铜反应生成氧化铜,热的氧化铜再氧化醇生成醛。某实验室中用甲醇、水、空气和铜粉(或氧化铜)制取甲醛的水溶液。下表给出甲醇、甲醛的沸点和水溶性:
|
|
沸点/℃ |
水溶性 |
|
甲醇 |
65 |
与水混溶 |
|
甲醛 |
-21 |
与水混溶 |
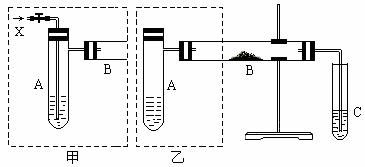 下图是两个同学设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,分别如甲和乙所示
下图是两个同学设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,分别如甲和乙所示
请回答下列问题:
(1)在仪器组装完成后,加装试剂前必须要进行的操作是____________________。
(2)若按甲装置进行实验,则通入A的X是______,B中发生反应的化学方程式为__________________________。(有机分子用结构简式表示)
(3)若按乙装置进行实验,则B管中应装入的物质是_____,B管中的现象为 。
(4)两套装置中都需要加热的仪器有______(填A、B、C)。
(5)若欲得到较浓的甲醛溶液,你认为选用哪套装置较好?______(填“甲”或“乙”)。
(6)验证实验后试管C中含有甲醛,所用试剂是__________。
28.(16分)现有部分元素的存在、性质或原子结构如下表所示:
|
A |
最外层电子数是次外层电子数的2倍的元素 |
|
B |
最高正价为+7价的短周期元素 |
|
C |
最外层电子数等于电子层数的短周期元素 |
|
D |
地壳中含量居第二位的金属元素 |
|
E |
其氢化物在同主族元素氢化物中熔沸点最高 |
|
F |
短周期元素中原子半径(除稀有气体外)最大的元素 |
请回答下列问题:
(1)写出由上述条件可以确定的元素的元素符号: 。
(2)若E的气态氢化物能与E的最高价氧化物对应的水化物发生化合反应生成离子化合物,则E的气态氢化物的电子式为: ,空间构型为: 。
(3)已知由至少满足表中一项条件的元素所组成的高中常见的物质之间可以发生如下图所示的转化关系。其中甲、乙、丙为含有同一种元素的纯净物(反应条件略)。
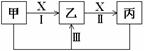 ①Ⅰ、若X为非金属元素的单质,图中反应均为氧化还原反应,
①Ⅰ、若X为非金属元素的单质,图中反应均为氧化还原反应,
则X为 (填化学式),反应Ⅲ的化学方程式为 。
Ⅱ、若X为金属元素的单质,图中反应均为氧化还原反应,
则X为 (填化学式),反应Ⅲ的化学方程式为 。
②若X为HCl,图中反应均为非氧化还原反应,则可能的情况有多种,试写出其中两种:
第一种:甲为 (填化学式),反应Ⅲ的离子方程式为 。
第二种:甲为 (填化学式),反应Ⅲ的离子方程式为 。
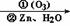 (CH3)2C=O+CH3CHO
(CH3)2C=O+CH3CHO
 2SO3(g);△H<0。
2SO3(g);△H<0。