12.下表是稀硫酸与某金属反应的实验数据:
|
实验序号 |
金属 质量/g |
金属 状态 |
c(H2SO4) mol·-1L |
V(H2SO4) /mL |
溶液温度/℃ |
金属消失的时间/s |
|
|
反应前 |
反应后 |
||||||
|
1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
|
2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
|
3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
|
4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
|
5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
|
6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
|
7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
|
8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
|
9 |
0.10 |
丝 |
1.1 |
50 |
30 |
44 |
40 |
分析上述数据,回答下列问题:
(1)实验4和5表明,____________对反应速率有影响,____________反应速率越快,
能表明同一规律的实验还有____________(填实验序号)。
(2)仅表明反应物浓度对反应速率产生影响的实验有- (填实验序号)。
(3)本实验中影响反应速率的其他因素还有____________,其实验序号是____________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:______________________________________ 。
10.在相同条件下进行Mg与HCl、CH3COOH反应的对照实验,相关数据如下:
|
|
Mg的质量 |
酸量 |
开始时反应速率 |
产生H2总量 |
|
Ⅰ |
0.24 g |
HCl0.2 mol·-1L100 mL |
v1 |
n1 |
|
Ⅱ |
0.24 g |
CH3COOH 0.2 mol·-1L100 mL |
v2 |
N2 |
(1)试比较有关量的大小:
v1____________v2,n1____________N2(填“>”、“=”或“<”)。
(2)现欲改变条件,使实验Ⅰ中的v1降低,但不改变n1的值,试写出两种可行的方法。
方法①____________ 。
方法②____________ 。
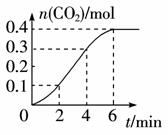
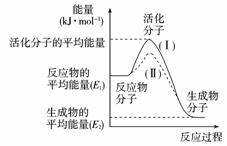
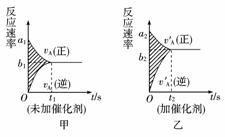
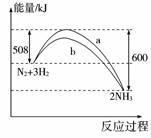
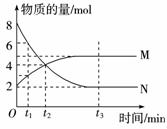 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如右图所示,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如右图所示,下列表述中正确的是( )