56、 (福建省龙岩一中2009-2010学年度高三第七次月考,24)(1)80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4 2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
(福建省龙岩一中2009-2010学年度高三第七次月考,24)(1)80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4 2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
①计算20s-40s内用N2O4表示的平均反应速率为 ②计算在80℃时该反应的平衡常数K= ;
③反应进行至l00s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”) ;
④要增大该反应的K值,可采取的措施有(填序号) ;
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(2)①丙烷脱氢可得丙烯。
 已知:C3H8(g) CH4(g)+HC=CH(g)+H2(g);△H1=156.6 kJ·mol-1
已知:C3H8(g) CH4(g)+HC=CH(g)+H2(g);△H1=156.6 kJ·mol-1
 CH4(g)+HC=CH(g) CH3CH=CH2(g);△H2=-32.4
kJ·mol-1
CH4(g)+HC=CH(g) CH3CH=CH2(g);△H2=-32.4
kJ·mol-1
 则相同条件下,反应C3H8(g) CH3CH=CH2(g)+ H2(g)的△H= ;
则相同条件下,反应C3H8(g) CH3CH=CH2(g)+ H2(g)的△H= ;
②以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池总反应方程式为 ;
③常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液c(H2CO3) c(CO32-)(填“>”、“=”或“<”'),原因是 。(用文字说明)
(1)①0.0020mol/(L.s)②1.8
③变浅 ④D
(2)①124.2kJ.mol-1
②C3H8+5O2 3CO2+4H2O;③>;HCO3-的水解程度大于电离程度。
55、(2010年温州市高三第一次适应性测试,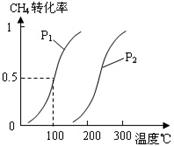 27)甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
27)甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为
100L),在一定条件下发生反应:CH4(g)+H2O(g)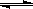
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关
系如右图。
①已知100℃时达到平衡所需的时间为5min,则用H2表
示的平均反应速率为_▲_。
②图中的P1_▲_P2(填“<”、“>”或“=”),100℃时平衡
常数为_▲_。
③在其它条件不变的情况下降低温度,逆反应速率将_▲_(填“增大”、“减小”或“不变”)。
(2)在压强为0.1
MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)
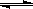 CH3OH(g) ……Ⅱ。
CH3OH(g) ……Ⅱ。
④该反应的△H_▲_0,△S_▲_0(填“<”、“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是_▲_。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了
 三组实验,部分实验条件已经填在下面实验设计表中。
三组实验,部分实验条件已经填在下面实验设计表中。
|
实验编号 |
T(℃) |
n (CO)/n(H2) |
P(MPa) |
|
ⅰ |
150 |
1/3 |
0.1 |
|
ⅱ |
_▲_ |
_▲_ |
5 |
|
ⅲ |
350 |
_▲_ |
5 |
A.请在上表空格中填入剩余的实验条件数据。
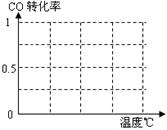
B.根据反应Ⅱ的特点,在给出的坐标图中,画出其在0.1MPa和5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
(1)①0.0030mol·L-1·min-1(2分,单位1分) ②<(1分) 2.25×10-4(2分) ③减小(1分)
(2)④< <(各1分共2分) ⑤BD(2分)
 ⑥A(每空1分共3分)
B.(曲线1、压强 1共2分)
⑥A(每空1分共3分)
B.(曲线1、压强 1共2分)
|
实验编号 |
T(℃) |
n (CO)/n(H2) |
P(MPa) |
|
ⅰ |
|
|
|
|
ⅱ |
150 |
1/3 |
|
|
ⅲ |
|
1/3 |
|
54、(北京市宣武区2010届上学期期末质量检测,18) 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) +
H2O(g) ΔH2
CH3OH(g) +
H2O(g) ΔH2
① 上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
② 下表所列数据是反应I在不同温度下的化学平衡常数(K)。
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:

(3)某实验小组依据甲醇燃烧的反应原理,
设计如右图所示的电池装置。
该电池正极的电极反应为
。
② 工作一段时间后,测得溶液的
pH减小,该电池总反应的化学方程式为
。
(1)① I ② < ③ 80% 250℃
(2) CH3OH(l)+ O2(g) = CO(g) + 2H2O(l) ΔH=﹣442.8 kJ∕mol
(3)① O2 + 2H2O + 4e- = 4OH-
② 2CH3OH + 3O2 + 4OH- = 2CO32- + 6H2O
高频考点十九 化学反应速率与化学平衡综合题
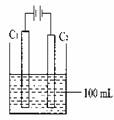
53、(山东省潍坊市2010届高三教学质量抽样检测C
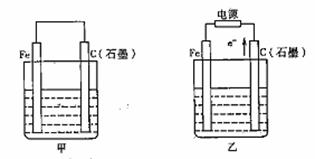 ,21)如图甲、乙是电化学实验装置。
,21)如图甲、乙是电化学实验装置。
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为 ;
②乙中总反应的离子方程式为 ;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为 。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为 ;
②如果起始时乙中盛有200mLpH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入 (填写物质的化学式) g。
(1)①O2+2H2O+4e-→4OH-
|
②2Cl-+2H2O====2OH-+H2↑+Cl2↑
③5Cl2+I2+6H2O=10HCl+2HIO3
(2)①Fe→Fe2++2e-
②CuO(或CuCO3) 0.8(或1.24)
52、(安徽师大附中2010届教学质量监测,23)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素是
(2)X与W组成的化合物中存在 键(填“离子”“共价”)。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为 。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH溶液反应的离子方程式 。
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式
。
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1 mol B中含有6mol结晶水。对化合物B进行如下实验:
a 取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b 另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
① B的化学式为 。
② 已知1 mol·L-1 100mL B的溶液能与1 mol·L-1 20mLKMnO4溶液(硫酸酸化)恰好反应。写出反应的离子方程式 。
(1)H(1分)2)共价(1分)
|
(4)① NH4+ + OH- ===== H2O + NH3↑ (2分)
② SO32- + Cl2 + H2O = SO42- + 2Cl- + 2H+ (2分)
(5)① (NH4)2Fe (SO4)2·6H2O (2分)
② 5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O (2分)
高频考点十八 电化学综合题
 4NO+6H2O; (2分)
4NO+6H2O; (2分)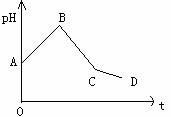 ,24)
,24)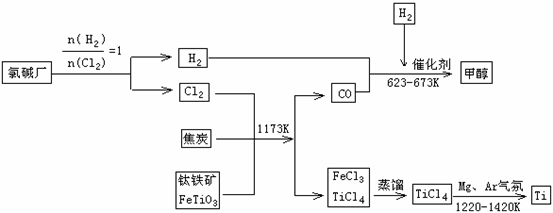 金属钛被称为铁和铝之后掘起的“第三金属”,常见化合价为+4,0,它是空间技术、航海、化工、医疗上不可缺少的材料,为了提高资源的利用率,减少环境污染,可将氯碱厂、炼钛厂和甲醇厂组成产业链,其关系如下图所示。
金属钛被称为铁和铝之后掘起的“第三金属”,常见化合价为+4,0,它是空间技术、航海、化工、医疗上不可缺少的材料,为了提高资源的利用率,减少环境污染,可将氯碱厂、炼钛厂和甲醇厂组成产业链,其关系如下图所示。 (1)钛铁矿经氧化法得到四氯化钛的化学反应为:
(1)钛铁矿经氧化法得到四氯化钛的化学反应为: 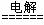 Cl2 ↑+ H2 ↑+ 2OH- 2分
Cl2 ↑+ H2 ↑+ 2OH- 2分  CH3OH(g)
CH3OH(g) (3)在其他条件不变的情况下,
(3)在其他条件不变的情况下, (5)使用燃料电池是节能减排的重要手段之一。CO和H2(俗称水煤气)燃料电池就是其中的一种,该电池的两极分别通入燃料气(水煤气)和氧气。电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。水煤气在一定条件下可以合成二甲醚,同时还产生一种可以参与大气循环的无机化合物,3CO + 3H2 = CH3OCH3 + CO2
或 2CO+4H2 = CH3OCH3
+ H2O。
(5)使用燃料电池是节能减排的重要手段之一。CO和H2(俗称水煤气)燃料电池就是其中的一种,该电池的两极分别通入燃料气(水煤气)和氧气。电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。水煤气在一定条件下可以合成二甲醚,同时还产生一种可以参与大气循环的无机化合物,3CO + 3H2 = CH3OCH3 + CO2
或 2CO+4H2 = CH3OCH3
+ H2O。 2CO2(g)+3H2O(l) △H=-1455kJ·mol-
1 (2分)
2CO2(g)+3H2O(l) △H=-1455kJ·mol-
1 (2分)
 (4)I元素在周期表里的位置在第 周期、第 族。
(4)I元素在周期表里的位置在第 周期、第 族。 )
)