网址:http://m.1010jiajiao.com/timu3_id_66669[举报]
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 737 | 1451 | 7733 | 10540 |

(2)金属钛被称为铁和铝之后崛起的第三金属,Ti原子的电子排布式为
(3)在①SiO32-、②SO32-、③CH3OH、④CS2、⑤CCl4五种微粒中,中心原子采取sp3杂化的有

请回答下列问题:
(1)写出钛铁矿经氯化法得到四氯化钛的化学方程式
(2)TiCl4暴露在潮湿空气中冒白烟,白烟主要为白色的二氧化钛的水合物H2TiO3,试写出该反应的化学方程式:
(3)已知:①Mg(s)+Cl2(g)=MgCl2(s)△H=-641kJ?mol-1
②
| 1 |
| 2 |
| 1 |
| 2 |
则Mg 与TiCl4反应的热化学方程式为
(4)在上述产业链中,合成96t 甲醇理论上需额外补充H2
(15分)金属钛被称为铁和铝之后崛起的第三金属,它是空间技术、航海、化工、医疗上不可缺少的材料。
I、工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:

其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
(1)净化钛矿石时,是否需要除去杂质FeO?答:_________(填“需要”或“不需要”)
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的离子方程式 。
II、为了提高资源的利用率,减少环境污染,可将氯碱厂、炼钛厂和甲醇厂组成产业链,其关系如下图所示。
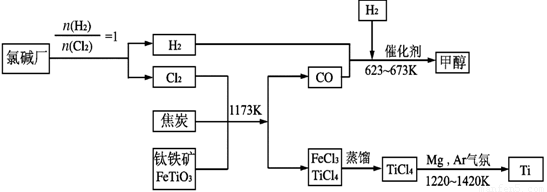
(3)写出钛铁矿经氯化法得到四氯化钛的化学方程式_________________________。
(4)已知:①Mg(s)+Cl2(g)=MgCl2(s);△H=一641 kJ·mol-1
②1/2Ti(s)+Cl2(g)=1/2TiCl4(l);△H=一385 kJ·mol-1
则Mg 与TiCl4反应的热化学方程式为 ,
该反应在氩气氛中进行的理由是 。
(5)在上述产业链中,合成192 t 甲醇理论上需额外补充H2 t (不考虑生产过程中物质的任何损失)。
查看习题详情和答案>>
(14分)金属钛被称为铁和铝之后崛起的“第三金属”,常见化合价为+4。它是空间技术、航海、化工、医疗上不可缺少的材料。
Ⅰ.工业上用钛铁矿(主要成分FeTiO3)制备金属钛的一种工艺流程如下图(部分产物略去):
(1)步骤①反应的化学方程式为:2FeTiO3 + 6C + 7Cl2 2FeCl3 + 2TiCl4 + 6CO,还原剂是 。
2FeCl3 + 2TiCl4 + 6CO,还原剂是 。
(2)步骤②分离出TiCl4的方法,利用了TiCl4与FeCl3 的不同。
(3)步骤④反应的化学方程式为________________________________,该反应在氩气中进行的理由是________________________ ______。
(4)绿色化学提倡物料循环。以上流程中,可用于循环的物质除Cl2、Mg外,还有____________。
II. 工业上也可用TiO2通过下述两种方法制备金属钛:
方法一:先将TiO2氯化为TiCl4,再还原得到Ti。
(5)氯化反应TiO2 (s ) +2Cl2 (g)
) +2Cl2 (g)  TiCl4(l) + O2 (g) 无法自发正向进行,在反应器中加入碳,则在高温条件下反应可顺利进行。试从化学平衡角度解释,往氯化反应器中加碳的原因: 。
TiCl4(l) + O2 (g) 无法自发正向进行,在反应器中加入碳,则在高温条件下反应可顺利进行。试从化学平衡角度解释,往氯化反应器中加碳的原因: 。
方法二:以熔融盐为电解液电解TiO2获得Ti。其中,碳块为阳极,电极反应式为:2O2ˉ– 4eˉ=O2↑;TiO2作阴极,被还原。
(6)阴极的电极反应式为 。
(7)电解过程中需定期向电解槽中加入碳块的原因是 。
金属钛被称为铁和铝之后崛起的“第三金属”,常见化合价为+4。它是空间技术、航海、化工、医疗上不可缺少的材料。
工业上用钛铁矿(主要成分FeTiO3)制备金属钛的一种工艺流程如下图(部分产物略去):
(1)步骤①反应的化学方程式为:2FeTiO3 + 6C + 7Cl2 2FeCl3 + 2TiCl4 + 6CO,还 原剂是 ,每生成1mol TiCl4转移 mol电子。
2FeCl3 + 2TiCl4 + 6CO,还 原剂是 ,每生成1mol TiCl4转移 mol电子。
(2)步骤②分离出TiCl4的方法,利用了TiCl4与FeCl3 的不同。
(3)步骤④反应的化学方程式为______________ __________,该反应在氩气中进行的理由是_________ _____________________。
(4)绿色化学提倡物料循环。以上流程中,可用于循环的物质除Cl2、Mg外,还有___。