摘要:(安徽师大附中2010届教学质量监测.23)原子序数由小到大排列的四种短周期元素X.Y.Z.W.四种元素的原子序数之和为32.在周期表中X是原子半径最小的元素.Y.Z左右相邻.Z.W位于同主族. (1)X元素是 (2)X与W组成的化合物中存在 键. (3)由X.Y.Z.W四种元素中的三种组成的一种强酸.该强酸的稀溶液能与铜反应.离子方程式为 . (4)由X.Y.Z.W四种元素组成的一种离子化合物A ①已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体.写出加热条件下A与NaOH溶液反应的离子方程式 . ②又知A既能与盐酸反应.又能与氯水反应.写出A与氯水反应的离子方程式 . (5)由X.Y.Z.W和Fe五种元素组成的式量为392的化合物B.1 mol B中含有6mol结晶水.对化合物B进行如下实验: a 取B的溶液加入过量浓NaOH溶液并加热.产生白色沉淀和无色刺激性气味气体.过一段时间白色沉淀变为灰绿色.最终变为红褐色, b 另取B的溶液.加入过量BaCl2溶液产生白色沉淀.加盐酸沉淀不溶解 ① B的化学式为 . ② 已知1 mol·L-1 100mL B的溶液能与1 mol·L-1 20mLKMnO4溶液恰好反应.写出反应的离子方程式 . △ (3)3Cu + 2NO3- + 8H+ === 3Cu2+ + 2NO↑ + 4H2O (4)① NH4+ + OH- ===== H2O + NH3↑ ② SO32- + Cl2 + H2O = SO42- + 2Cl- + 2H+ (5)① (NH4)2Fe (SO4)2·6H2O ② 5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O 高频考点十八 电化学综合题
网址:http://m.1010jiajiao.com/timu3_id_66663[举报]
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
(1)X元素是
(2)X与W组成的化合物中存在
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为
(4)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体.写出加热条件下A与NaOH溶液反应的离子方程式
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1mol B中含有6mol结晶水.对化合物B进行如下实验:
a 取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体.过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b 另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
①B的化学式为
②已知1mol?L-1 100mL B的溶液能与1mol?L-1 20mLKMnO4溶液(硫酸酸化)恰好反应.写出反应的离子方程式
查看习题详情和答案>>
(1)X元素是
H
H
(2)X与W组成的化合物中存在
共价
共价
键(填“离子”“共价”).(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为
3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O
3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O
.(4)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体.写出加热条件下A与NaOH溶液反应的离子方程式
NH4++OH-
H2O+NH3↑
| ||
NH4++OH-
H2O+NH3↑
.
| ||
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式
SO32-+Cl2+H2O=SO42-+2Cl-+2H+
SO32-+Cl2+H2O=SO42-+2Cl-+2H+
.(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1mol B中含有6mol结晶水.对化合物B进行如下实验:
a 取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体.过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b 另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
①B的化学式为
(NH4)2Fe(SO4)2?6H2O
(NH4)2Fe(SO4)2?6H2O
.②已知1mol?L-1 100mL B的溶液能与1mol?L-1 20mLKMnO4溶液(硫酸酸化)恰好反应.写出反应的离子方程式
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
.X、Y、Z、W为按原子序数由小到大排列的四种短周期的元素.其申Y、W位 于同一主族,Z、W位于同一周期;Y的最外层电子数是K层电子数的3倍;Z是同一周期中金属性最强的元素,X为非金属元素,其最外层电子数与Z相同.请回答下列问题:
(1)Y的元素名称是 .
(2)Z2W的电子式是 .
(3)Z Y X中含有的化学键为 .
(4)Z2Y2与X2Y反应的离子方程式是: .
(5)A和B均由以上四种元素构成,请写出它们之间反应的离子方程式: .
(6)若把铜片放入X2WY4溶液中,溶液无明显的变化,若在X2WY4溶液中加入X2Y2后,观察到铜片附近的溶液变蓝色,请写出反应的化学方程式: .
查看习题详情和答案>>
(1)Y的元素名称是
(2)Z2W的电子式是
(3)Z Y X中含有的化学键为
(4)Z2Y2与X2Y反应的离子方程式是:
(5)A和B均由以上四种元素构成,请写出它们之间反应的离子方程式:
(6)若把铜片放入X2WY4溶液中,溶液无明显的变化,若在X2WY4溶液中加入X2Y2后,观察到铜片附近的溶液变蓝色,请写出反应的化学方程式:
原子序数由小到大排列的四种短周期元素X、Y、Z、W,它们的原子序数之和为26,在同周期中W的原子半径最大,W和Z可形成W2Z和W2Z2;X、Y、Z三种元素中的任意两种之间可以组成甲、乙、丙…等许多种化合物.
(1)这四种元素的符号分别是X
 .
.
(2)甲是一种气体,通入紫色石蕊试液中,溶液变红.甲的分子式为
(3)乙是一种化石燃料,其分子呈正四面体构型,写出它的电子式
 ;560mL(标准状况下)乙完全燃烧生成液态水,产生热量22.25kJ.写出乙燃烧热的热化学方程式为
;560mL(标准状况下)乙完全燃烧生成液态水,产生热量22.25kJ.写出乙燃烧热的热化学方程式为
(4)丙是X和Z按原子个数比1:1组成的化合物.已知丙的溶液能使酸性高锰酸钾溶液褪色.将含有0.5mol丙的溶液滴加到100mL 2mol?L-1酸性高锰酸钾溶液中,溶液紫色恰好褪色.该反应的离子方程式为:
查看习题详情和答案>>
(1)这四种元素的符号分别是X
H
H
、YC
C
、ZO
O
、WNa
Na
,用电子式表示W2Z形成过程

(2)甲是一种气体,通入紫色石蕊试液中,溶液变红.甲的分子式为
CO2
CO2
,写出甲与W2Z2反应的化学方程式2CO2+2Na2O2=2Na2CO3+O2
2CO2+2Na2O2=2Na2CO3+O2
.(3)乙是一种化石燃料,其分子呈正四面体构型,写出它的电子式


CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═-890kJ?mol-1
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═-890kJ?mol-1
.(4)丙是X和Z按原子个数比1:1组成的化合物.已知丙的溶液能使酸性高锰酸钾溶液褪色.将含有0.5mol丙的溶液滴加到100mL 2mol?L-1酸性高锰酸钾溶液中,溶液紫色恰好褪色.该反应的离子方程式为:
2MnO4-+5H2O2+6H+=2Mn2++8H2O+502 ↑
2MnO4-+5H2O2+6H+=2Mn2++8H2O+502 ↑
.X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
①X元素原子价电子排布式为ns2np2,且原子半径是同族元素中最小的.
②Y元素是地壳中含量最多的元素;W在同周期中原子半径最小,在W原子的电子排布中,p轨道上只有1个未成对电子.
③Z元素的电离能数据见下表(kJ/mol):
请回答:
(1)Z2Y2的电子式为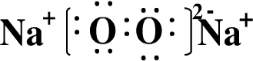
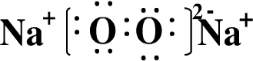 ,Z2Y2与水反应的化学方程式
,Z2Y2与水反应的化学方程式
(2)X、Y二种元素所形成的常见稳定的化合物的晶体类型为
(3)X、Y、Z、W四种元素所形成的单质中,硬度最大、熔点最高的是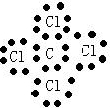
 .
.
查看习题详情和答案>>
①X元素原子价电子排布式为ns2np2,且原子半径是同族元素中最小的.
②Y元素是地壳中含量最多的元素;W在同周期中原子半径最小,在W原子的电子排布中,p轨道上只有1个未成对电子.
③Z元素的电离能数据见下表(kJ/mol):
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
(1)Z2Y2的电子式为
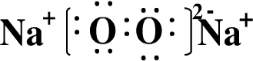
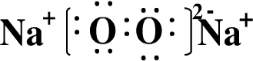
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
(2)X、Y二种元素所形成的常见稳定的化合物的晶体类型为
分子晶体
分子晶体
,空间构型为直线形
直线形
(3)X、Y、Z、W四种元素所形成的单质中,硬度最大、熔点最高的是
金刚石
金刚石
(填名称); XW4 的电子式为

原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
(1)X元素是
(2)X与Y 形成化合物的电子式为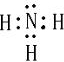
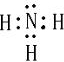 ,X与W组成的化合物中存在
,X与W组成的化合物中存在
(3)写出实验室制备YX3的化学方程式:
(4)由X、Y、Z、W四种元素组成的一种离子化合物A,已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体.则A的名称是
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1mol B中含有6mol结晶水.对化合物B进行如下实验:
a. 取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体.过一段时间白色沉淀变为灰绿色,最终变为红褐色;b. 另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解则B的化学式为
查看习题详情和答案>>
(1)X元素是
氢
氢
(填名称),W在周期表中的位置第三周期第ⅥA族
第三周期第ⅥA族
.(2)X与Y 形成化合物的电子式为
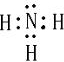
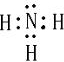
共价
共价
键(填“离子”“共价”).(3)写出实验室制备YX3的化学方程式:
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
(4)由X、Y、Z、W四种元素组成的一种离子化合物A,已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体.则A的名称是
硫酸铵
硫酸铵
.(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1mol B中含有6mol结晶水.对化合物B进行如下实验:
a. 取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体.过一段时间白色沉淀变为灰绿色,最终变为红褐色;b. 另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解则B的化学式为
(NH4)2Fe(SO4)2?6H2O
(NH4)2Fe(SO4)2?6H2O
.