2.温度对化学反应速率的影响
实验:用类似于上述“实验2”的方法,根据下表完成实验。
|
编号 |
加Na2S2O3溶液的体积/mL |
加H2O的体积/mL |
加H2SO4溶液的体积/mL |
温度/℃ |
所需时间/s |
|
1 |
5 |
5 |
2 |
室温 |
|
|
2 |
5 |
5 |
2 |
热水浴 |
|
|
3 |
5 |
5 |
2 |
沸水浴 |
|
现象与解释:溶液出现混浊现象使烧杯底部的“+”字看不见所需的时间,第1个烧杯最长,第3个烧杯时间最短。3个烧杯中,第1个烧杯中温度最低,第3个烧杯中温度最高,温度越高反应速率越快。
1.浓度对化学反应速率的影响
实验1:在两支放有少量大理石的试管里,分别加入10mL1mol/L的盐酸和10mL0.1mol/L的盐酸。观察现象。
现象与解释:在加入10mL1mol/L的盐酸的试管中有大量气泡逸出,而在加入10mL0.1mol/L的盐酸的试管中,气泡产生的很慢。许多实验证明,当其他条件不变时,增大反应物浓度,可以增大化学反应速率。
 实验2:取三个小烧杯,编号为1、2、3。用黑笔在烧杯底部画上“+”字。按下表中的数量先分别在烧杯中加入Na2S2O3溶液和蒸馏水,摇匀。然后再同时向3个烧杯中加入2mLH2SO4溶液,搅拌并记录开始时间,到溶液出现混浊现象使烧杯底部的“+”字看不见时,停止计时。
实验2:取三个小烧杯,编号为1、2、3。用黑笔在烧杯底部画上“+”字。按下表中的数量先分别在烧杯中加入Na2S2O3溶液和蒸馏水,摇匀。然后再同时向3个烧杯中加入2mLH2SO4溶液,搅拌并记录开始时间,到溶液出现混浊现象使烧杯底部的“+”字看不见时,停止计时。
|
编号 |
加Na2S2O3溶液的体积/mL |
加H2O的体积/mL |
 加H2SO4溶液的体积/mL 加H2SO4溶液的体积/mL |
所需时间/s |
|
1 |
5 |
5 |
2 |
|
|
2 |
7 |
3 |
2 |
|
|
3 |
10 |
0 |
2 |
|
现象与解释:溶液出现混浊现象使烧杯底部的“+”字看不见所需的时间,第1个烧杯最长,第3个烧杯时间最短。3个烧杯中,第1个烧杯Na2S2O3的浓度最小,反应速率最慢;第3个烧杯Na2S2O3的浓度最大,反应速率最快。
 实验3:如图所示,在烧杯里放入硫酸铜溶液,用一铁制品(用酸洗净)作阴极,铜片作阳极。通电,观察铁制品表面颜色的变化。
实验3:如图所示,在烧杯里放入硫酸铜溶液,用一铁制品(用酸洗净)作阴极,铜片作阳极。通电,观察铁制品表面颜色的变化。 实验:把一块锌片和一块铜片平行地插入盛有稀硫酸的烧杯中,可以看到锌片上有气泡产生,铜片上没有气泡产生。再用导线把锌片和铜片连接起来(如右图),观察现象。
实验:把一块锌片和一块铜片平行地插入盛有稀硫酸的烧杯中,可以看到锌片上有气泡产生,铜片上没有气泡产生。再用导线把锌片和铜片连接起来(如右图),观察现象。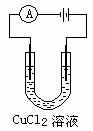
 N2O4(g) ;ΔH<0
N2O4(g) ;ΔH<0