18、水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g)  CO
(g) +H2 (g) △H= +131.3 kJ•mol-1
CO
(g) +H2 (g) △H= +131.3 kJ•mol-1
(1)该反应的平衡常数K随温度的升高而___________(增大 / 减小 / 不变)。
(2)上述反应达到平衡后,将体系中的C (s)全部移走,平衡_______________(向左移 / 向右移 / 不移动)。
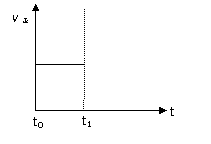 (3)上述反应在t0时刻达到平衡(如右下图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
(3)上述反应在t0时刻达到平衡(如右下图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
① 缩小容器体积(用实线表示)
② 降低温度(用虚线表示)
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
|
容器编号 |
c(H2O)/mol·L-1 |
c(CO)/mol·L-1 |
c(H2)/mol·L-1 |
ν正、ν逆比较 |
|
I |
0.06 |
0.60 |
0.10 |
ν正=ν逆 |
|
Ⅱ |
0.12 |
0.20 |
________ |
ν正=ν逆 |
|
Ⅲ |
0.10 |
0.20 |
0.40 |
ν正____ν逆 |
(5)己知:2C (s) + O2(g) = 2CO (g) △H = -221.0 kJ·mo1-1
2CO(g) + O2(g) = 2CO2 (g) △H = -566.0 kJ·mo1-1
2H2 (g) + O2 (g) = 2H2O (g) △H = -483.6 kJ·mo1-1
若将24 g 炭完全转化为水煤气,然后再充分燃烧,整个过程的焓变为 kJ。
17、减少SO2的排放、回收利用SO2成为世界性的研究课题。我国研究人员研制的利用低品位软锰矿浆(主要成分是MnO2)吸收废渣高温焙烧产生的SO2,制备硫酸锰的生产流程如下:

浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。
有关金属离子的半径以及形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
|
离子 |
离子半径(pm) |
开始沉淀时的pH |
完全沉淀时的pH |
|
Fe2+ |
74 |
7.6 |
9.7 |
|
Fe3+ |
64 |
2.7 |
3.7 |
|
Al3+ |
50 |
3.8 |
4.7 |
|
Mn2+ |
80 |
8.3 |
9.8 |
|
Pb2+ |
121 |
8.0 |
8.8 |
|
Ca2+ |
99 |
- |
- |

已知PbO2的氧化性大于MnO2。请回答下列问题:
⑴ 写出浸出过程中主要反应的化学方程式 ,
氧化过程中主要反应的离子方程式 。
⑵ 在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至 。
⑶ 阳离子吸附剂用于除去杂质金属离子。决定阳离子吸附剂吸附效果的因素是 (填写序号)。
a.溶液的pH b.金属离子的电荷 c.金属离子的半径 d.吸附时间
⑷ 操作a包括 等过程。
五,本题包括1小题。
 A.无色溶液中:K+、H+、SO32-、MnO4-
A.无色溶液中:K+、H+、SO32-、MnO4-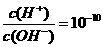 的溶液中:K’、Na+、CO32-、AlO2-
的溶液中:K’、Na+、CO32-、AlO2- C、能使pH试纸变红的溶液中:Ca2+、Na+、CO32-、SO42-
C、能使pH试纸变红的溶液中:Ca2+、Na+、CO32-、SO42-



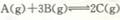

 3、镁及其化合物一般无毒、无污染,且镁电池放电时电压高而平稳,使镁成为人们研制绿色电池的焦点之一。某种镁电池的工作原理为,有关该电池放电时的下列说法中错误的是( )
3、镁及其化合物一般无毒、无污染,且镁电池放电时电压高而平稳,使镁成为人们研制绿色电池的焦点之一。某种镁电池的工作原理为,有关该电池放电时的下列说法中错误的是( ) (4)F的核外电子排布式是 ,F的高价离子与A的简单氢化物形成的配离子的化学式为 .
(4)F的核外电子排布式是 ,F的高价离子与A的简单氢化物形成的配离子的化学式为 .

 的方案:
的方案: 提示:① 合成过程中无机试剂任选;
提示:① 合成过程中无机试剂任选;
