15. 已知25℃时有关弱酸的电离平衡常数:
|
弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数(25℃) |
1.8×l0-5 |
4.9×l0-10 |
K1=4.3×l0-7 K2=5.6×l0-11 |
则下列有关说法正确的是( )
A、等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B、a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b
C、冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小
D、NaHCO3和Na2CO3等物质的量混合溶液中,一定存在:
c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
 2FeCl3
(3)Fe+2H+=Fe2++H2↑
(4)2Fe2++Cl2=2Fe3++2Cl-
2、SiO2;CaSiO3;Na2SiO3;Si;H4SiO4(H2SiO3 )
3、C
4、⑴A.N2;B.NH3;C.NO;D.NO2;E.HNO3;4NH3+5O2
2FeCl3
(3)Fe+2H+=Fe2++H2↑
(4)2Fe2++Cl2=2Fe3++2Cl-
2、SiO2;CaSiO3;Na2SiO3;Si;H4SiO4(H2SiO3 )
3、C
4、⑴A.N2;B.NH3;C.NO;D.NO2;E.HNO3;4NH3+5O2 4NO+6H2O
⑵ 2H2S+3O2
4NO+6H2O
⑵ 2H2S+3O2 2SO2+2H2O )
5、碳、二氧化碳、碳酸钙、碳酸氢钙 CO2+Ca2++2OH-==CaCO3↓+H2O
CaCO3+CO2+H2O==Ca2++2HCO3- HCO3-+H+==CO2↑+H2O
HCO3-+OH-==CO32-+H2O
6、A:CO2、NO2; B:NO
C:Cu D:Cu(NO3)2溶液
7、① NH3、NO、CO2,NO2、HCl、H2②NO和CO2,2:3
8、(1)
2SO2+2H2O )
5、碳、二氧化碳、碳酸钙、碳酸氢钙 CO2+Ca2++2OH-==CaCO3↓+H2O
CaCO3+CO2+H2O==Ca2++2HCO3- HCO3-+H+==CO2↑+H2O
HCO3-+OH-==CO32-+H2O
6、A:CO2、NO2; B:NO
C:Cu D:Cu(NO3)2溶液
7、① NH3、NO、CO2,NO2、HCl、H2②NO和CO2,2:3
8、(1)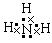 (2)2F2 + 2H2O = 4HF + O2, 4NH3 + 5O2
(2)2F2 + 2H2O = 4HF + O2, 4NH3 + 5O2  12、(1)2S2―+SO32―+6H+=3S↓+3H2O
(2)Al3++3HCO3―=Al(OH)3↓+3CO2↑
(3)BaCO3或BaCO3与BaSO4的混合物;在所得沉淀丙中加入稀盐酸,若沉淀全部溶解,说明沉淀丙是BaCO3 ,若沉淀仅部分溶解,说明沉淀是BaCO3和BaSO4的混合物。
(4)气体甲有5种可能:①H2S②SO2 ③CO2④CO2和H2S ⑤CO2和SO2(5)Na+
、S2―、SO32―、AlO2―;Ag+、Ba2+、Al3+;CO32―、SO42―
13、(1)二氧化硅、氧化钙、碳化钙。(2)复分解反应。(3)Si+2NaOH+2H2O=Na2SiO3+2H2+H2O。(4)HC≡CH+HCl
12、(1)2S2―+SO32―+6H+=3S↓+3H2O
(2)Al3++3HCO3―=Al(OH)3↓+3CO2↑
(3)BaCO3或BaCO3与BaSO4的混合物;在所得沉淀丙中加入稀盐酸,若沉淀全部溶解,说明沉淀丙是BaCO3 ,若沉淀仅部分溶解,说明沉淀是BaCO3和BaSO4的混合物。
(4)气体甲有5种可能:①H2S②SO2 ③CO2④CO2和H2S ⑤CO2和SO2(5)Na+
、S2―、SO32―、AlO2―;Ag+、Ba2+、Al3+;CO32―、SO42―
13、(1)二氧化硅、氧化钙、碳化钙。(2)复分解反应。(3)Si+2NaOH+2H2O=Na2SiO3+2H2+H2O。(4)HC≡CH+HCl 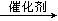 CH2=CHCl。
14、⑴ ⅢA族ⅥA族 ⑵ Al2S3 ⑶ 2/3mol
15、(1)硫化铵(或硫氢化钠)(2)水(碱溶液)
酸(盐)(3)2H2S+3O2
CH2=CHCl。
14、⑴ ⅢA族ⅥA族 ⑵ Al2S3 ⑶ 2/3mol
15、(1)硫化铵(或硫氢化钠)(2)水(碱溶液)
酸(盐)(3)2H2S+3O2 2NH3
18、解析:A盐固体受热分解为三种物质,且为非氧化还原反应。由此很容易想到可能是(NH4)2CO3或NH4HCO3。又因为电解Z盐溶液生成三种物质,其中两种物质(X和Y)为单质,且X与F化合生成D,结合这两点,X应为H2,F为N2,D为NH3。这样Z盐应似NaCl或KCl,则Y为Cl2,W为NaOH或KOH,A盐确实为(NH4)2CO3或NH4HCO3,B为CO2,G为Na2CO3或NaHCO3,C为水,E为HCl或NH4Cl(NH3过量时)。答案:(1)(NH4)2CO3或NH4HCO3 N2 H2 Cl2
(2)CO2+2NaOH====Na2CO3+H2O或CO2+NaOH====NaHCO3 (3)N2+3H2
2NH3
18、解析:A盐固体受热分解为三种物质,且为非氧化还原反应。由此很容易想到可能是(NH4)2CO3或NH4HCO3。又因为电解Z盐溶液生成三种物质,其中两种物质(X和Y)为单质,且X与F化合生成D,结合这两点,X应为H2,F为N2,D为NH3。这样Z盐应似NaCl或KCl,则Y为Cl2,W为NaOH或KOH,A盐确实为(NH4)2CO3或NH4HCO3,B为CO2,G为Na2CO3或NaHCO3,C为水,E为HCl或NH4Cl(NH3过量时)。答案:(1)(NH4)2CO3或NH4HCO3 N2 H2 Cl2
(2)CO2+2NaOH====Na2CO3+H2O或CO2+NaOH====NaHCO3 (3)N2+3H2 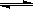 2NH3
19、(1)H2 (2)第二 IVA H:C∷C:H (3) H2O+C
2NH3
19、(1)H2 (2)第二 IVA H:C∷C:H (3) H2O+C 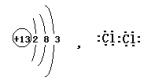 (2)Al3++3AlO2-+6H2O====4Al(OH)3↓ (3)4FeCl2+O2+8NaOH+2H2O====4Fe(OH)3+8NaCl
或FeCl2+2NaOH====Fe(OH)2↓+2NaCl 4Fe(OH)2+O2+2H2O====4Fe(OH)3
(2)Al3++3AlO2-+6H2O====4Al(OH)3↓ (3)4FeCl2+O2+8NaOH+2H2O====4Fe(OH)3+8NaCl
或FeCl2+2NaOH====Fe(OH)2↓+2NaCl 4Fe(OH)2+O2+2H2O====4Fe(OH)3
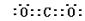 23、(1)O2 (2)略
(3)2SO2+O2===2SO3
2H2O =====2H2+O2
24、(1)硝酸第四周期,Ⅷ族(2)2Na2O2+2CO2=2Na2CO3+O2
2Fe3++2CO32-+3H2O=2Fe(OH)3↓+3CO2↑
25、(1)NH4HCO3或(NH4)2CO3 NO2 (2)4NH3+5O2
23、(1)O2 (2)略
(3)2SO2+O2===2SO3
2H2O =====2H2+O2
24、(1)硝酸第四周期,Ⅷ族(2)2Na2O2+2CO2=2Na2CO3+O2
2Fe3++2CO32-+3H2O=2Fe(OH)3↓+3CO2↑
25、(1)NH4HCO3或(NH4)2CO3 NO2 (2)4NH3+5O2  Al2O3+3H2O
(4)2H2S+SO2
Al2O3+3H2O
(4)2H2S+SO2 34、(1)
34、(1)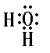 3Fe+4H2O(气)
3Fe+4H2O(气)  说明:不写条件扣分,不配平扣分,化学式写错不得分(下同)
说明:不写条件扣分,不配平扣分,化学式写错不得分(下同) (2)Mg ,O=C=O, 2Mg+CO2
(2)Mg ,O=C=O, 2Mg+CO2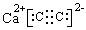 (2)2NaCl+2H2O
(2)2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2NaOH+H2↑+Cl2↑
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
 37、(1)Fe NO Mg(2)①C+4HNO3(浓)
37、(1)Fe NO Mg(2)①C+4HNO3(浓)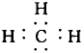 CaC2
(2)4NH3+5O2
CaC2
(2)4NH3+5O2
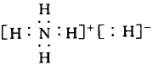 3NH5+AlCl3+3H2O=Al(OH)3↓+3NH4Cl+3H2↑(分步写也得分)
44、(1)H2;硝酸铵
(2) 4NH3+5O2
3NH5+AlCl3+3H2O=Al(OH)3↓+3NH4Cl+3H2↑(分步写也得分)
44、(1)H2;硝酸铵
(2) 4NH3+5O2
 (1)A是__________,B是__________,C是__________(请填写化学式);
(2)反应①的化学方程式______________________________;
(3)反应③的离子方程式______________________________;
(4)反应④的离子方程式______________________________。
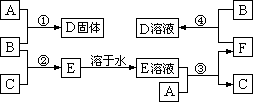
2、A、B、C、D、E五种物质均含有同一种元素,它们能发生如下图所示的变化。
(1)A是__________,B是__________,C是__________(请填写化学式);
(2)反应①的化学方程式______________________________;
(3)反应③的离子方程式______________________________;
(4)反应④的离子方程式______________________________。
2、A、B、C、D、E五种物质均含有同一种元素,它们能发生如下图所示的变化。
 写出五种物质的化学式:A______B_______C_______D_______E__________
3、某混和气体可能含有H2、CO、CO2、HCl、NH3和水蒸气中的两种或多种,当混和气体依次通过:①澄清石灰水(无浑浊现象);②氢氧化钡溶液(有浑浊现象);③浓H2SO4( 无现象);④灼热氧化铜(变红);⑤无水硫酸铜(变蓝).(假设每一次吸收均完全).对该混和气体成分判断正确的是
A.一定没有CO2,肯定有H2 B.一定有CO、CO2和水蒸气
C.一定有H2、CO2和HCl
D.可能有CO2、NH3和水蒸气
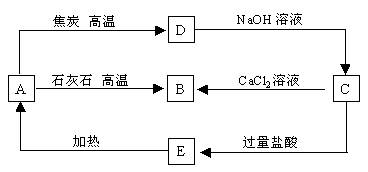
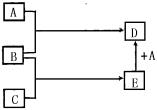
4、A、B、C、D、E五种物质在一定条件下的转化关系如图所示。
写出五种物质的化学式:A______B_______C_______D_______E__________
3、某混和气体可能含有H2、CO、CO2、HCl、NH3和水蒸气中的两种或多种,当混和气体依次通过:①澄清石灰水(无浑浊现象);②氢氧化钡溶液(有浑浊现象);③浓H2SO4( 无现象);④灼热氧化铜(变红);⑤无水硫酸铜(变蓝).(假设每一次吸收均完全).对该混和气体成分判断正确的是
A.一定没有CO2,肯定有H2 B.一定有CO、CO2和水蒸气
C.一定有H2、CO2和HCl
D.可能有CO2、NH3和水蒸气
4、A、B、C、D、E五种物质在一定条件下的转化关系如图所示。
 (1)若A在常温下为气态单质,则A为_______;B为_______;C为_______;D为_______;E为____;由B→C变化的化学方程式________________________________________
(2)若A在常温下为固态单质。则B→C变化的化学方程式__________________________________________________
2
5、有一种黑色粉末A在纯氧中充分燃烧生成气体B,加入少量澄清石灰水,出现白色沉淀C,振荡后沉淀消失得溶液D,把D分成两份,一份中加入稀HCl,又生成气体B,另一份加入NaOH溶液又得沉淀C。则A、B、C、D的名称依次为____________、___________、____________、____________。有关的离子方程式为:
B→C_________________________________________________________,
C→D_________________________________________________________,
D→B_________________________________________________________,
D→C_________________________________________________________。
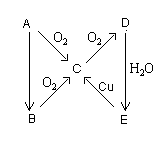
6、将红热的固体单质M放入浓硝酸中,剧烈反应,产生混合气体A。A在常温下不与空气接触时发生如下图所示的变化。
(1)若A在常温下为气态单质,则A为_______;B为_______;C为_______;D为_______;E为____;由B→C变化的化学方程式________________________________________
(2)若A在常温下为固态单质。则B→C变化的化学方程式__________________________________________________
2
5、有一种黑色粉末A在纯氧中充分燃烧生成气体B,加入少量澄清石灰水,出现白色沉淀C,振荡后沉淀消失得溶液D,把D分成两份,一份中加入稀HCl,又生成气体B,另一份加入NaOH溶液又得沉淀C。则A、B、C、D的名称依次为____________、___________、____________、____________。有关的离子方程式为:
B→C_________________________________________________________,
C→D_________________________________________________________,
D→B_________________________________________________________,
D→C_________________________________________________________。
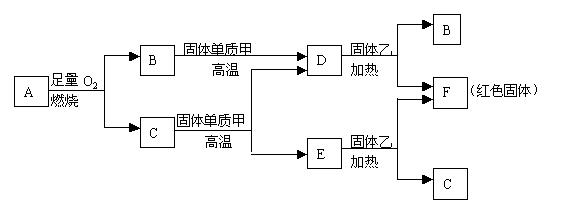
6、将红热的固体单质M放入浓硝酸中,剧烈反应,产生混合气体A。A在常温下不与空气接触时发生如下图所示的变化。
 A是 ,B是
,C是
,D是
(填化学式)
7、一无色气体,可能由CO2、HCl、NH3、NO2、NO、H2中的一种或几种组成。将此无色气体通过盛有浓H2SO4的洗气瓶,发现气体体积减少。继续通过装有固体Na2O2的干燥管,发现从出气管出来的气体颜色显红棕色,再将该气体全部通入盛满水倒立于水槽中的试管内,发现最后试管里仍然为一满试管液体。由此可推知:①原气体中一定含有_____________,一定不会有 ____________;②最终结果可知原气体中_____________气体的体积比为_______。
8、A、B、C、D为中学化学中常见的四种气体单质。在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙;C和D化合生成化合物丁。已知甲、乙、丙的每个分子中含有10个电子,并且甲、乙、丙、丁有如下关系:
A是 ,B是
,C是
,D是
(填化学式)
7、一无色气体,可能由CO2、HCl、NH3、NO2、NO、H2中的一种或几种组成。将此无色气体通过盛有浓H2SO4的洗气瓶,发现气体体积减少。继续通过装有固体Na2O2的干燥管,发现从出气管出来的气体颜色显红棕色,再将该气体全部通入盛满水倒立于水槽中的试管内,发现最后试管里仍然为一满试管液体。由此可推知:①原气体中一定含有_____________,一定不会有 ____________;②最终结果可知原气体中_____________气体的体积比为_______。
8、A、B、C、D为中学化学中常见的四种气体单质。在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙;C和D化合生成化合物丁。已知甲、乙、丙的每个分子中含有10个电子,并且甲、乙、丙、丁有如下关系:
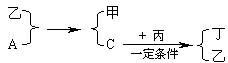 试回答:
(1)丙的电子式为___________________
(2)A和乙,单质C和丙所发生反应的化学方程式分别为______________________________,_______________________________________
(3)丙和丁能否在一定条件下反应?_________(填能或不能)。
9、右图是某元素及其重要化合物的相互转化关系图(生成物中不含该元素的物质均已略去),图中A是单质,D在常温下呈气态,F可用作化肥,也可用来作炸药。
(1)写出A的电子式 和F的化学式
;
(2)写出下列变化的化学方程式:
B→C:
E→C:
试回答:
(1)丙的电子式为___________________
(2)A和乙,单质C和丙所发生反应的化学方程式分别为______________________________,_______________________________________
(3)丙和丁能否在一定条件下反应?_________(填能或不能)。
9、右图是某元素及其重要化合物的相互转化关系图(生成物中不含该元素的物质均已略去),图中A是单质,D在常温下呈气态,F可用作化肥,也可用来作炸药。
(1)写出A的电子式 和F的化学式
;
(2)写出下列变化的化学方程式:
B→C:
E→C:
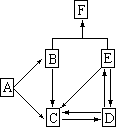 10、下图中的每一个方格表示有关的一种反应物或生成物,其中A、C为无色气体
10、下图中的每一个方格表示有关的一种反应物或生成物,其中A、C为无色气体
 ⑴写出有关的物质化学式X: C:
E: F:
⑵写出反应①的化学方程式_____________________________________
⑶写出反应②的离子方程式_____________________________________
11、A、B、C、D为中学化学中常见的四种气体单质。在一定条件下,B可以分别和ACD化合生成甲、乙、丙,C和D化合生成化合物丁。已知甲、乙、丙的每个分子中含有的电子数相等,并且甲、乙、丙、丁有入如下图所示关系:
⑴写出有关的物质化学式X: C:
E: F:
⑵写出反应①的化学方程式_____________________________________
⑶写出反应②的离子方程式_____________________________________
11、A、B、C、D为中学化学中常见的四种气体单质。在一定条件下,B可以分别和ACD化合生成甲、乙、丙,C和D化合生成化合物丁。已知甲、乙、丙的每个分子中含有的电子数相等,并且甲、乙、丙、丁有入如下图所示关系:
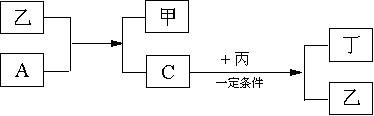 请填写下列空白:
(1)单质B的化学式是 ,电子式
。
(2)单质A和化合物乙发生反应的化学方程式是
,单质C和化合物丙发生反应的化学方程式是
。
(3)试根据化合物丙、丁中D元素的化合价,判断丙与丁能否在一定条件下发生化学反应生成D单质。若认为能反应,写出反应的化学方程式,若认为不能反应,简要说明理由。能否:
;反应方程式或理由
。
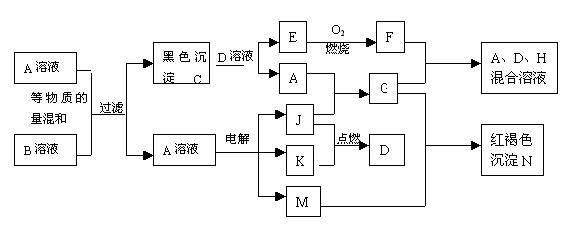
12、某无色溶液,其中可能存在如下离子:Na+、Ag+、Ba2+、Al3+、AlO2―、S2―、CO32―、SO32―、SO42―,现取该溶液进行有关实验,结果与下图所示。
请填写下列空白:
(1)单质B的化学式是 ,电子式
。
(2)单质A和化合物乙发生反应的化学方程式是
,单质C和化合物丙发生反应的化学方程式是
。
(3)试根据化合物丙、丁中D元素的化合价,判断丙与丁能否在一定条件下发生化学反应生成D单质。若认为能反应,写出反应的化学方程式,若认为不能反应,简要说明理由。能否:
;反应方程式或理由
。
12、某无色溶液,其中可能存在如下离子:Na+、Ag+、Ba2+、Al3+、AlO2―、S2―、CO32―、SO32―、SO42―,现取该溶液进行有关实验,结果与下图所示。
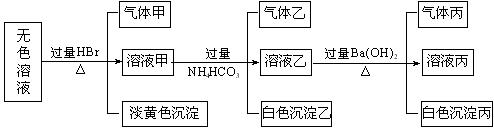 试回答下列问题:
(1)生成沉淀甲的离子方程式为
。
(2)由溶液甲生成沉淀乙的离子方程式
。
(3)沉淀丙是
。如何用一化学实验来确定其成分
。
(4)气体甲的成分有哪几种可能 。
(5)综合上述信息,可以肯定存在的离子有
,一定不存在的离子是
,可能存在的离子是 。
13、已知:A、B、E为固体化合物;D、G为固体单质;F、X、Z为可燃性气体,且F、X燃烧的火焰呈蓝色或淡蓝色。在一定条件下它们能实现如图所示的变化。
试回答下列问题:
(1)生成沉淀甲的离子方程式为
。
(2)由溶液甲生成沉淀乙的离子方程式
。
(3)沉淀丙是
。如何用一化学实验来确定其成分
。
(4)气体甲的成分有哪几种可能 。
(5)综合上述信息,可以肯定存在的离子有
,一定不存在的离子是
,可能存在的离子是 。
13、已知:A、B、E为固体化合物;D、G为固体单质;F、X、Z为可燃性气体,且F、X燃烧的火焰呈蓝色或淡蓝色。在一定条件下它们能实现如图所示的变化。
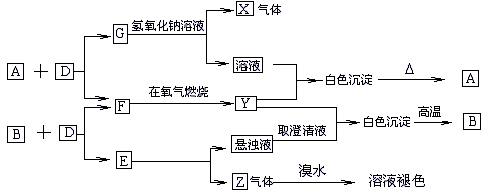 (1)写出A、B、Z、的名称。A_________,B________,E____________。
(2)G跟氢氧化钠溶液反应生成气体X和溶液,写出Y跟这种溶液所发生反应的类型______________________。
(2)写出G和氢氧化钠溶液反应的化学方程式_______________________。
(3)写出1molZ跟1molHCl反应的化学方程式________________________。
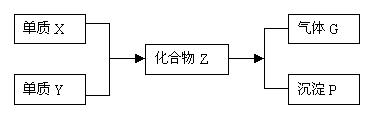
14、在一定条件下,单质X和单质Y反应,生成化合物Z,Z与水作用可生成气体G和白色沉淀P(如下框图所示),已知气体G与空气之密度比约为1.17
请填空:⑴ 组成单质X和Y的元素分别属第 族和第
族。 ⑵ 化合物Z的化学式为
。 ⑶ 每生成1mol的气体G,同时应得到
mol的沉淀P。
(1)写出A、B、Z、的名称。A_________,B________,E____________。
(2)G跟氢氧化钠溶液反应生成气体X和溶液,写出Y跟这种溶液所发生反应的类型______________________。
(2)写出G和氢氧化钠溶液反应的化学方程式_______________________。
(3)写出1molZ跟1molHCl反应的化学方程式________________________。
14、在一定条件下,单质X和单质Y反应,生成化合物Z,Z与水作用可生成气体G和白色沉淀P(如下框图所示),已知气体G与空气之密度比约为1.17
请填空:⑴ 组成单质X和Y的元素分别属第 族和第
族。 ⑵ 化合物Z的化学式为
。 ⑶ 每生成1mol的气体G,同时应得到
mol的沉淀P。
 15、下图每一字母代一种反应物或生成物。已知在常温下A是固体,B、C、E、F、G均为气态化合物,X为气态单质。根据下列反应框图填空(有些反应条件已略去)。
15、下图每一字母代一种反应物或生成物。已知在常温下A是固体,B、C、E、F、G均为气态化合物,X为气态单质。根据下列反应框图填空(有些反应条件已略去)。
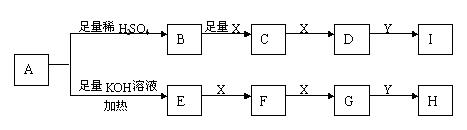 (1)A物质的名称为
。
(2)当Y是 ,则I和H溶液中溶质属于(填酸、碱、盐、氧化物) 类。
(3)写出发生下列转化的化学方程式
B→C
E→F
(4)写出E与F在一定条件下反应,且生成物中有一种单质产生的化学方程式
16、A、B、C、D为四种单质,常温时,A、B是气体,C、D是固体,E、F、G、H、I为五种化合物,F不溶于水,E为气体且极易溶于水成为无色溶液,g溶于水得棕黄色溶液。这九种物质间反应的转化关系如下图所示。
(1)A物质的名称为
。
(2)当Y是 ,则I和H溶液中溶质属于(填酸、碱、盐、氧化物) 类。
(3)写出发生下列转化的化学方程式
B→C
E→F
(4)写出E与F在一定条件下反应,且生成物中有一种单质产生的化学方程式
16、A、B、C、D为四种单质,常温时,A、B是气体,C、D是固体,E、F、G、H、I为五种化合物,F不溶于水,E为气体且极易溶于水成为无色溶液,g溶于水得棕黄色溶液。这九种物质间反应的转化关系如下图所示。
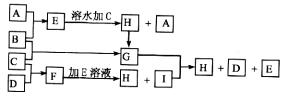 (1)写出四种单质的化学式:A ,B ,C ,D 。
(2)写出E + F→H + I的离子方程式:
。
(3)写出G + I→H + D + E的化学方程式:
。
17、
(1)写出四种单质的化学式:A ,B ,C ,D 。
(2)写出E + F→H + I的离子方程式:
。
(3)写出G + I→H + D + E的化学方程式:
。
17、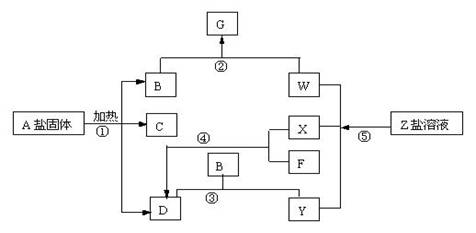 在一定条件下(不需添加另的反应物),经不同的化学反应,可实现如上图的各种变化。其中,反应③④⑤属氧化还原反应,而反应①、②属非氧化还原反应。X、F和Y为单质,且F是空气的主要成份之一,其余为化合物,据此请填空:
⑴物质A是
,F是
,X是
,Y是
。
⑵写出反应②的化学方程式:
。
⑶写出反应④的化学方程式,并注明反应条件:
。
18、在一定条件下(不需要添加别的反应物),经不同的化学反应,可实现如下图的各种反应。其中,反应③、④、⑤属氧化还原反应,而反应 ①、②属非氧化还原反应。X、F和Y为单质,且F是空气的主要组成成分之一,其余为化合物,据此请填空:
在一定条件下(不需添加另的反应物),经不同的化学反应,可实现如上图的各种变化。其中,反应③④⑤属氧化还原反应,而反应①、②属非氧化还原反应。X、F和Y为单质,且F是空气的主要成份之一,其余为化合物,据此请填空:
⑴物质A是
,F是
,X是
,Y是
。
⑵写出反应②的化学方程式:
。
⑶写出反应④的化学方程式,并注明反应条件:
。
18、在一定条件下(不需要添加别的反应物),经不同的化学反应,可实现如下图的各种反应。其中,反应③、④、⑤属氧化还原反应,而反应 ①、②属非氧化还原反应。X、F和Y为单质,且F是空气的主要组成成分之一,其余为化合物,据此请填空:
 (1)物质A是 ,F是
,X是
,Y是
。
(2)写出反应②的化学方程式
。
(3)写出反应④的化学方程式,并注明反应条件
。
19、气体 A只含 X、Y两种短周期元素,X的原子序数大于 Y的原子序数。B、D、E是中学化学中的常见气体。固体乙是一种复杂的化合物,是具有磁性的黑色晶体;F是目前用途最广、用量最大的金属单质,F与C在高温下发生反应生成Z和固体乙。各物质有如下图所示的转化关系。
(1)物质A是 ,F是
,X是
,Y是
。
(2)写出反应②的化学方程式
。
(3)写出反应④的化学方程式,并注明反应条件
。
19、气体 A只含 X、Y两种短周期元素,X的原子序数大于 Y的原子序数。B、D、E是中学化学中的常见气体。固体乙是一种复杂的化合物,是具有磁性的黑色晶体;F是目前用途最广、用量最大的金属单质,F与C在高温下发生反应生成Z和固体乙。各物质有如下图所示的转化关系。
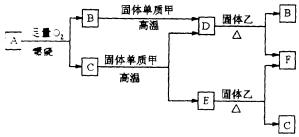 试回答下列问题:
(1)若气体A中,X与Y的质量比小于3,则气体A中肯定有(写化学式)__________。
(2)若气体A的分子为线型结构,且X与Y两元素的质量比数值上等于X的相对原子质量,则X元素位于周期表________周期,________族,A的电子式为_______________。
(3)写出下列反应的化学方程式(是离子反应的,写离子方程式):
在高温下,C与固体甲反应_________________________________________________,
在高温下,F与C反应
____________________________________________________,
F与足量稀HNO3反应
____________________________________________。
20、A、B广泛存在于自然界中,是构成岩石的主要成分。X、Y、Z都是无色可燃性气体。它们在一定条件下能实现下图所示变化:
试回答下列问题:
(1)若气体A中,X与Y的质量比小于3,则气体A中肯定有(写化学式)__________。
(2)若气体A的分子为线型结构,且X与Y两元素的质量比数值上等于X的相对原子质量,则X元素位于周期表________周期,________族,A的电子式为_______________。
(3)写出下列反应的化学方程式(是离子反应的,写离子方程式):
在高温下,C与固体甲反应_________________________________________________,
在高温下,F与C反应
____________________________________________________,
F与足量稀HNO3反应
____________________________________________。
20、A、B广泛存在于自然界中,是构成岩石的主要成分。X、Y、Z都是无色可燃性气体。它们在一定条件下能实现下图所示变化: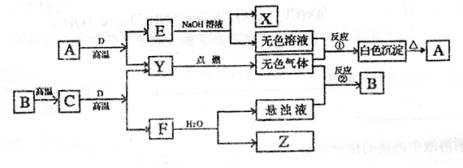 (1)如果Z是能使溴水褪色的有机化合物,则X为
,Y为
,Z
(填写化学式)。
(2)写出反应①和②的离子方程式。
反应:①
反应:②
21、有A、B、C、D四种单质,在一定条件下,A、B、C分别跟D发生化合反应相应生成甲、乙、丙(甲、乙、丙每个分子中都含有10个电子)而B跟C发生化合反应生成丁,这些单质和化合物之间发生如下反应关系:
(1)如果Z是能使溴水褪色的有机化合物,则X为
,Y为
,Z
(填写化学式)。
(2)写出反应①和②的离子方程式。
反应:①
反应:②
21、有A、B、C、D四种单质,在一定条件下,A、B、C分别跟D发生化合反应相应生成甲、乙、丙(甲、乙、丙每个分子中都含有10个电子)而B跟C发生化合反应生成丁,这些单质和化合物之间发生如下反应关系:
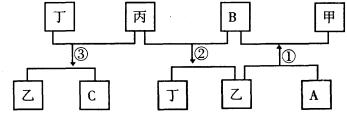 (1)写出下列物质的化学式
甲______________乙___________丙_____________丁_____________
(2)写出反应①②③的化学方程式
①____________________________________
②_________________________________________
③_________________________________________________________。
22、在一定条件下可实现下图所示物质之间的变化,其中甲、乙、丙、丁、戊表示单质,其它字母表示化合物。
(1)写出下列物质的化学式
甲______________乙___________丙_____________丁_____________
(2)写出反应①②③的化学方程式
①____________________________________
②_________________________________________
③_________________________________________________________。
22、在一定条件下可实现下图所示物质之间的变化,其中甲、乙、丙、丁、戊表示单质,其它字母表示化合物。
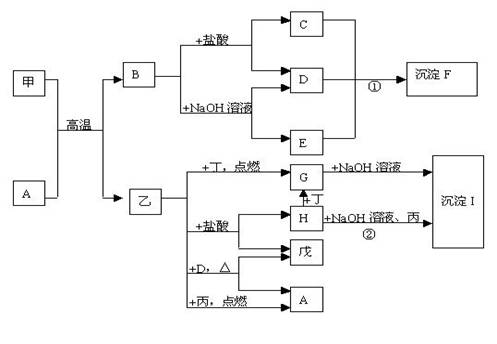 请填写下列空白:
(1)物质A的化学式是
,甲的原子结构示意图是
,
丁的电子式是
。
(2)反应①的离子方程式是
。
(3)反应②的化学方程式是
。
23、已知甲、乙、丙是三种常见的单质,且组成它们的三种元素的核电荷数之和为35,A到H是八种常见化合物。上述各物质间的相互关系见下图所示(反应条件省略):
请填写下列空白:
(1)物质A的化学式是
,甲的原子结构示意图是
,
丁的电子式是
。
(2)反应①的离子方程式是
。
(3)反应②的化学方程式是
。
23、已知甲、乙、丙是三种常见的单质,且组成它们的三种元素的核电荷数之和为35,A到H是八种常见化合物。上述各物质间的相互关系见下图所示(反应条件省略):
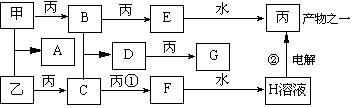 试回答:
(1)丙的化学式是__________________
(2)用电子式表示A的形成过程_____________________
_________
(3)写出①②两步的化学方程式:
①________________________________________
__
②___________________________________
_______
24、已知:下图中的物质均为中学化学中常见物质;常温下,A、C、F、H、J、K为固体,D、G为气体;A为常见金属单质;B为重要的工业原料,可用于制备炸药,其浓溶液通常呈黄色;E的溶液呈黄色;C、D均为由两种短周期元素组成的化合物;G为动植物生命活动中不可缺少的物质;方框中字母代表反应物或生成物(部分生成物已略去)。
试填空:
试回答:
(1)丙的化学式是__________________
(2)用电子式表示A的形成过程_____________________
_________
(3)写出①②两步的化学方程式:
①________________________________________
__
②___________________________________
_______
24、已知:下图中的物质均为中学化学中常见物质;常温下,A、C、F、H、J、K为固体,D、G为气体;A为常见金属单质;B为重要的工业原料,可用于制备炸药,其浓溶液通常呈黄色;E的溶液呈黄色;C、D均为由两种短周期元素组成的化合物;G为动植物生命活动中不可缺少的物质;方框中字母代表反应物或生成物(部分生成物已略去)。
试填空: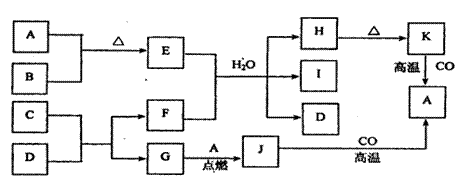 (1)B的名称 ;A在周期表中的位置
。
(2)写出化学反应方程式:C+D→F+G:
。
离子反应方程式:E+F→ H+I+D:
。
25、如图是常见物质的反应关系,其中部分产物被略去,常温下X是固体,B和G是液体,其余为气体。
(1)B的名称 ;A在周期表中的位置
。
(2)写出化学反应方程式:C+D→F+G:
。
离子反应方程式:E+F→ H+I+D:
。
25、如图是常见物质的反应关系,其中部分产物被略去,常温下X是固体,B和G是液体,其余为气体。 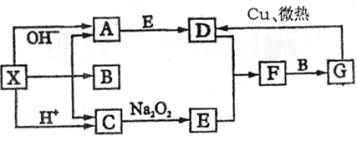 根据图中关系;
(1)推断下列物质的化学式:X
,F
。
(2)写出A→D反应的化学方程式
。
(3)写出C→E反应的化学方程式
。
26、饱和盐溶液W的电解产物发生下列的系列反应。图中的每一方格表示有关的一种主要反应物或生成物(反应中加入或生成的水以及生成的其他产物已略去)。其中A、B、C、D、E在常温常压下均是气态物质。
根据图中关系;
(1)推断下列物质的化学式:X
,F
。
(2)写出A→D反应的化学方程式
。
(3)写出C→E反应的化学方程式
。
26、饱和盐溶液W的电解产物发生下列的系列反应。图中的每一方格表示有关的一种主要反应物或生成物(反应中加入或生成的水以及生成的其他产物已略去)。其中A、B、C、D、E在常温常压下均是气态物质。
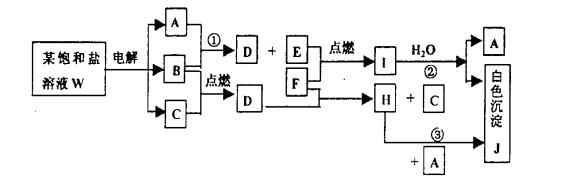 按照反应过程,分析下列问题。 (1)确定物质化学式:W
、C
。
(2)书写饱和盐溶液W的电解化学方程式:
。
(3)书写反应①②的化学方程式,若是氧化还原反应,标出电子转移的方向的数目:
①
、②
。(4)书写反应③的离子方程式:③
。
(5)物质I是一种离子化合物,用电子式表示其结构:
。
27、已知与外加电源正极相连的电极为电解池的阳极,与外加电源负极相连的电极为电解池的阴极,在以石墨为电极电解时,电解质溶液中的阴离子在阳极发生氧化反应,电解质溶液中的阳离子在阴极发生还原反应,又知阳离子得电子的能力与其对应金属的金属活动性顺序相反(注意:Fe3+>Cu2+>Fe2+ ),阴离子失电子的能力为S2->I->Br->Cl->OH->含氧酸根离子>F-。如图所示:以石墨为电极电解A的水溶液,并做下面一系列实验,试根据实验现象完成下列问题。电解质A的水溶液焰色反应呈浅紫色。
按照反应过程,分析下列问题。 (1)确定物质化学式:W
、C
。
(2)书写饱和盐溶液W的电解化学方程式:
。
(3)书写反应①②的化学方程式,若是氧化还原反应,标出电子转移的方向的数目:
①
、②
。(4)书写反应③的离子方程式:③
。
(5)物质I是一种离子化合物,用电子式表示其结构:
。
27、已知与外加电源正极相连的电极为电解池的阳极,与外加电源负极相连的电极为电解池的阴极,在以石墨为电极电解时,电解质溶液中的阴离子在阳极发生氧化反应,电解质溶液中的阳离子在阴极发生还原反应,又知阳离子得电子的能力与其对应金属的金属活动性顺序相反(注意:Fe3+>Cu2+>Fe2+ ),阴离子失电子的能力为S2->I->Br->Cl->OH->含氧酸根离子>F-。如图所示:以石墨为电极电解A的水溶液,并做下面一系列实验,试根据实验现象完成下列问题。电解质A的水溶液焰色反应呈浅紫色。
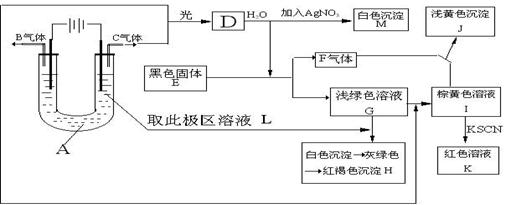 (1)、写出A的化学式为 ,E的名称为 。
(2)、I与F作用的离子方程式是
(3)、G加入L后产生的白色沉淀到生成红褐色沉淀H的化学方程式:
(4)、用两个最直接的离子方程式来证明Fe3+、Cu2+、Fe2+的氧化性强弱顺序是Fe3+>Cu2+>Fe2+ ①、
②、
28、A、B、C、D是中学化学中四种常见的非金属单质,在标准状况下,它们之中有三种呈气态,只有一种呈固态。B的相对分子质量很小。甲、乙、丙、X、Y五种物质都是化合物,这些化合物和A、B、C、D之间有如图所示关系:
(1)、写出A的化学式为 ,E的名称为 。
(2)、I与F作用的离子方程式是
(3)、G加入L后产生的白色沉淀到生成红褐色沉淀H的化学方程式:
(4)、用两个最直接的离子方程式来证明Fe3+、Cu2+、Fe2+的氧化性强弱顺序是Fe3+>Cu2+>Fe2+ ①、
②、
28、A、B、C、D是中学化学中四种常见的非金属单质,在标准状况下,它们之中有三种呈气态,只有一种呈固态。B的相对分子质量很小。甲、乙、丙、X、Y五种物质都是化合物,这些化合物和A、B、C、D之间有如图所示关系: 且知以上物质的所有组成元素均为短周期元素。根据以上事实,回答下列问题:
(1)化合物乙与氢氧化钠按物质的量之比1:3恰好完全反应,则乙的化学式是 。
(2)图中的化学反应共有
个化合反应,
个氧化还原反应。
(3)Y与甲反应生成乙和丙的化学方程式为:
。
29、
且知以上物质的所有组成元素均为短周期元素。根据以上事实,回答下列问题:
(1)化合物乙与氢氧化钠按物质的量之比1:3恰好完全反应,则乙的化学式是 。
(2)图中的化学反应共有
个化合反应,
个氧化还原反应。
(3)Y与甲反应生成乙和丙的化学方程式为:
。
29、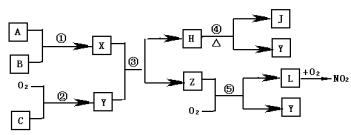 A、B、C、是单质,X、Y、Z、H、J、L是化合物,组成B的元素是绿色植物生活所必需的微量元素之一,且B在空气中燃烧可以得到X和J,X和J均为固体,X水
解可生成两种碱性物质。在适当条件下,它们相互之间有下图所所示的转化关系:
(1)用化学式表示化合物L
单质C
。
(2)物质Z的分子空间构型是
。
(3)反应①的化学方程式
。
(4)反应⑤的化学方程式
。
(5)在常温下用气体密度测定NO2的相对分子质量,实验值比理论纸值偏 (填“高”或“低”),其原因是 。
30、A、B两种盐均为无色晶体,其中A的焰色反应呈紫色(透过蓝色钴玻璃),A的水溶液pH值大于7。下面是A、B两种盐所进行的实验记录,其中H、G均为不溶于硝酸的白色沉淀,气体E、F均可使品红溶液褪色。
A、B、C、是单质,X、Y、Z、H、J、L是化合物,组成B的元素是绿色植物生活所必需的微量元素之一,且B在空气中燃烧可以得到X和J,X和J均为固体,X水
解可生成两种碱性物质。在适当条件下,它们相互之间有下图所所示的转化关系:
(1)用化学式表示化合物L
单质C
。
(2)物质Z的分子空间构型是
。
(3)反应①的化学方程式
。
(4)反应⑤的化学方程式
。
(5)在常温下用气体密度测定NO2的相对分子质量,实验值比理论纸值偏 (填“高”或“低”),其原因是 。
30、A、B两种盐均为无色晶体,其中A的焰色反应呈紫色(透过蓝色钴玻璃),A的水溶液pH值大于7。下面是A、B两种盐所进行的实验记录,其中H、G均为不溶于硝酸的白色沉淀,气体E、F均可使品红溶液褪色。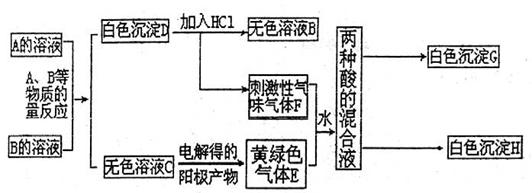 (1)写出A、B两种物质的化学式A
B
(2)写出E、F两物质反应的离子方程
。
(3)请写出将少量气体E通入过量的FeBr2溶液时发生的离子反应方程式(要求用双线桥法表示出电子转移的方向和数目)
。
(4)请写出物质C的电子式
。
(5)请写出电解C的无色溶液的化学方程式
。
31、已知A-G是中学化学中常见的7种物质,所有物质均由短周期元素组成,其中B、C、G都含有同一种元素,B、E、F都为单质。常温、常压下D为液体,E、F为气体,F是空气的主要成分之一。C由2种元素组成,其晶体熔点高、硬度大,闪烁着晶莹的光泽。A-C可以发生如下转化,其反应的关系如下图所示。请填写下列空白。
(1)写出A、B两种物质的化学式A
B
(2)写出E、F两物质反应的离子方程
。
(3)请写出将少量气体E通入过量的FeBr2溶液时发生的离子反应方程式(要求用双线桥法表示出电子转移的方向和数目)
。
(4)请写出物质C的电子式
。
(5)请写出电解C的无色溶液的化学方程式
。
31、已知A-G是中学化学中常见的7种物质,所有物质均由短周期元素组成,其中B、C、G都含有同一种元素,B、E、F都为单质。常温、常压下D为液体,E、F为气体,F是空气的主要成分之一。C由2种元素组成,其晶体熔点高、硬度大,闪烁着晶莹的光泽。A-C可以发生如下转化,其反应的关系如下图所示。请填写下列空白。
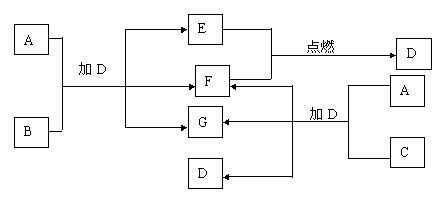 (1)写出E+F→D的化学反应方程式:
;
(2)B的化学式是
;
(3)如图所示A与C两种固体混合后,加入液体D,可能发生反应的化学方程式为
。
32、下图每一方框中的字母代表一种反应物或生成物:
(1)写出E+F→D的化学反应方程式:
;
(2)B的化学式是
;
(3)如图所示A与C两种固体混合后,加入液体D,可能发生反应的化学方程式为
。
32、下图每一方框中的字母代表一种反应物或生成物: 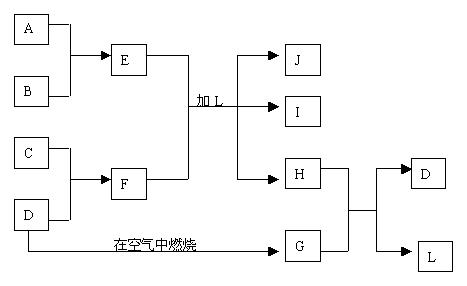 产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,D是淡黄色固体单质。试填写下列空白:
(1)L的化学式为: 。(2)F的化学式为:
。
(3)写出J受热分解反应的化学方程式:
。
(4)H和G之间反应的化学方程式为:
。
33、A、B、C、D分别是硝酸钡、氨水、氢氧化钠和碳酸氢钠四种溶液中的一种。现利用另一种溶液X,用如下图所示的方法,即可将它们一一确定。
产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,D是淡黄色固体单质。试填写下列空白:
(1)L的化学式为: 。(2)F的化学式为:
。
(3)写出J受热分解反应的化学方程式:
。
(4)H和G之间反应的化学方程式为:
。
33、A、B、C、D分别是硝酸钡、氨水、氢氧化钠和碳酸氢钠四种溶液中的一种。现利用另一种溶液X,用如下图所示的方法,即可将它们一一确定。
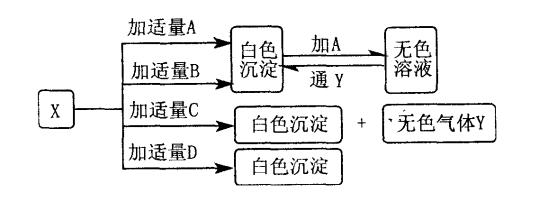 请写出:
(1)化学式A
,B
,C
,D
,X
。
(2)无色气体Y的电子式
。
(3)X与C反应的离子方程式
。
34、已知A、B、C均为常见的单质,其中A为金属,B、C为非金属,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略)。
请写出:
(1)化学式A
,B
,C
,D
,X
。
(2)无色气体Y的电子式
。
(3)X与C反应的离子方程式
。
34、已知A、B、C均为常见的单质,其中A为金属,B、C为非金属,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略)。
 请回答:
(1)若常温下B、C均为气体,D为黑色晶体,E的电子式为
,A和E在
一定条件下反应生成D的化学方程式为
。
(2)若常温下B为气体,C为黑色固体,则构成金属A的原子结构示意图为
,E的结构式为
,A和E在一定条件下反应生成D的化学方程式为
。
35、下图为中学化学中一些常见物质间发生的一系列转化的框图(反应所需和产生的水及某些反应条件已略去)。
请回答:
(1)若常温下B、C均为气体,D为黑色晶体,E的电子式为
,A和E在
一定条件下反应生成D的化学方程式为
。
(2)若常温下B为气体,C为黑色固体,则构成金属A的原子结构示意图为
,E的结构式为
,A和E在一定条件下反应生成D的化学方程式为
。
35、下图为中学化学中一些常见物质间发生的一系列转化的框图(反应所需和产生的水及某些反应条件已略去)。
 回答:
(1)物质C的电子式____________________
(2)写出反应的化学方程式。
反应①_______________________________________
反应②_______________________________________
反应③_______________________________________
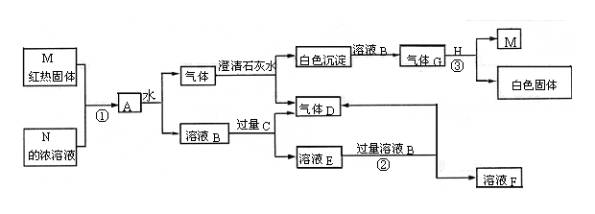
37、物质M、N、A、B、C、D、E、F、G、H,其中C、H为常见金属,且混合气体A在常温下不与空气接触时能发生如图所示变化(其他有关反应条件均略去):
回答:
(1)物质C的电子式____________________
(2)写出反应的化学方程式。
反应①_______________________________________
反应②_______________________________________
反应③_______________________________________
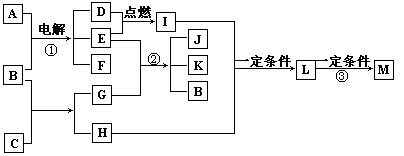
37、物质M、N、A、B、C、D、E、F、G、H,其中C、H为常见金属,且混合气体A在常温下不与空气接触时能发生如图所示变化(其他有关反应条件均略去):
 试回答:
(1)写出C、D和H的化学式:
C:
;D:
;H:
。
(2)写出反应①②③的化学方程式:
①
②
③
38、气体A只含有X、Y两种短周期元素,X的原子序数大于Y的原子序数。B、D、E是中学化学中常见的气体,各物质产间有如图13所示的转化关系:
试回答:
(1)写出C、D和H的化学式:
C:
;D:
;H:
。
(2)写出反应①②③的化学方程式:
①
②
③
38、气体A只含有X、Y两种短周期元素,X的原子序数大于Y的原子序数。B、D、E是中学化学中常见的气体,各物质产间有如图13所示的转化关系:
 请回答下列问题:
请回答下列问题: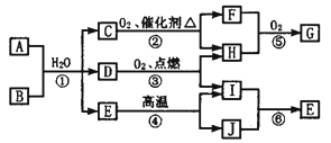 其中A为酸式盐,B为某二价主族金属的化合物,B在常温下可与水反应得D和碱,等物质的量A、B与适量水充分混合恰好完全反应;常温常压下,C、D均为气态;反应④和⑤分别是工业上生产化合物J和化合物G的重要方法。
其中A为酸式盐,B为某二价主族金属的化合物,B在常温下可与水反应得D和碱,等物质的量A、B与适量水充分混合恰好完全反应;常温常压下,C、D均为气态;反应④和⑤分别是工业上生产化合物J和化合物G的重要方法。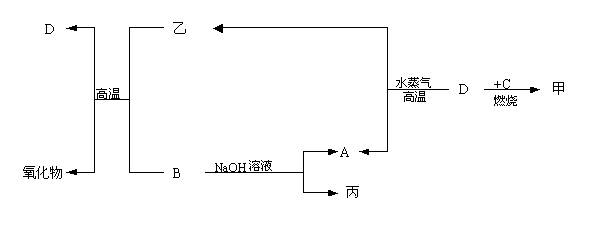 回答下列问题:
(1)A的电子式
。
(2)D与甲溶液反应的化学方程式
。
(3)丙的水溶液显
性(填酸或碱),原因是(用离子方程式表示)
。
(4)一定条件下,2molB与3molD的氧化物W恰好反应,则W的化学式
。
41、(2006杭州二检)下图所涉及的物质均为中学化学中的常见物质,其中C、D、E为单质,其余为化合物。
回答下列问题:
(1)A的电子式
。
(2)D与甲溶液反应的化学方程式
。
(3)丙的水溶液显
性(填酸或碱),原因是(用离子方程式表示)
。
(4)一定条件下,2molB与3molD的氧化物W恰好反应,则W的化学式
。
41、(2006杭州二检)下图所涉及的物质均为中学化学中的常见物质,其中C、D、E为单质,其余为化合物。
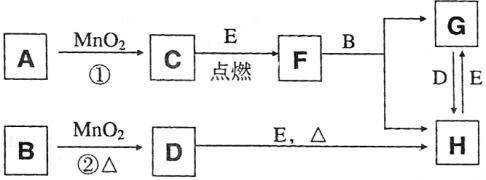 它们存在如下转化关系,反应中生成的水及次要产物均已略去。
(1)写化学化式:B
、E
。
(2)指出MnO2在相关反应中的作用:反应①中是 剂,反应②中是 剂。
(3)完成F与B发生反应的化学方程式
。
(4)若反应①是在加热条件下进行,A是 ;若反应①是在常温条件下进行,A是
。若在上述两种条件下得到等量的C单质,反应中转移的电子数之比为
。
42、已知:①A、B、C、D四种为短周期元素,且原子序数依次递增.②A、B、C三种元素的核电荷数之和等于D元素的核电荷数,且D元素的核电荷数为C元素核电荷数的2倍。③C、D元素同主族,且能在一定条件下发生下面两个反应:
它们存在如下转化关系,反应中生成的水及次要产物均已略去。
(1)写化学化式:B
、E
。
(2)指出MnO2在相关反应中的作用:反应①中是 剂,反应②中是 剂。
(3)完成F与B发生反应的化学方程式
。
(4)若反应①是在加热条件下进行,A是 ;若反应①是在常温条件下进行,A是
。若在上述两种条件下得到等量的C单质,反应中转移的电子数之比为
。
42、已知:①A、B、C、D四种为短周期元素,且原子序数依次递增.②A、B、C三种元素的核电荷数之和等于D元素的核电荷数,且D元素的核电荷数为C元素核电荷数的2倍。③C、D元素同主族,且能在一定条件下发生下面两个反应:
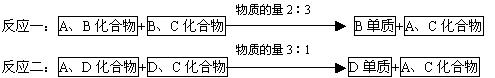 请回答:
(1)D元素最高价氧化物的水化物的化学式是 ,B单质的电子式是
,B、C原子半径大小关系为
.
(2)写出满足“反应二”的化学反应方程式
.
(3)由这四种元素组成的化合物中(四种元素都有),相同浓度下pH最小的化合物的化学式是 .
43、(2005潍坊统考)已知甲、乙、丙为常见的单质,A、B、C、D、X、Y、Z为常见化合物,且丙在常温常压下为气体,B为淡黄色固体,Y的摩尔质量数值比Z小16,乙、丙的摩尔质量相同,B的摩尔质量比D小2,B、X的摩尔质量相同。
各物质之间的转化关系如下图所示(各反应条件略)。
请回答:
(1)D元素最高价氧化物的水化物的化学式是 ,B单质的电子式是
,B、C原子半径大小关系为
.
(2)写出满足“反应二”的化学反应方程式
.
(3)由这四种元素组成的化合物中(四种元素都有),相同浓度下pH最小的化合物的化学式是 .
43、(2005潍坊统考)已知甲、乙、丙为常见的单质,A、B、C、D、X、Y、Z为常见化合物,且丙在常温常压下为气体,B为淡黄色固体,Y的摩尔质量数值比Z小16,乙、丙的摩尔质量相同,B的摩尔质量比D小2,B、X的摩尔质量相同。
各物质之间的转化关系如下图所示(各反应条件略)。
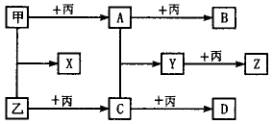 请回答:
(1)在B与二氧化碳的反应中,每有1 mol电子转移,生成气体____L(标准状况)。
(2)X与Y的溶液混合后,再加入适量盐酸,会有乙生成,反应的离子方程式是__________________________________________________。
(3)将C通入溴水中,所发生反应的化学方程式是__________;D属于______________晶体(填晶体类型)。
(4)在101 kPa时,4.0 g乙在一定条件下与丙完全反应生成C,放出37 kJ的热量,该反应的热化学方程式是__________________________________________________。
(5)比甲元素的原子序数少4的M元素,在一定条件下能与氢元素组成化合物MH5。已知MH5的结构与氯化铵相似,MH5与水作用有氢气生成,则MH5的电子式为______________(M要用元素符号表示)。写出MH5与AlCl3溶液反应的化学方程式_______________________________________。
44、(2005辽宁模拟)下图表示某化工生产的流程(有的反应条件和产物已略去)
请回答:
(1)在B与二氧化碳的反应中,每有1 mol电子转移,生成气体____L(标准状况)。
(2)X与Y的溶液混合后,再加入适量盐酸,会有乙生成,反应的离子方程式是__________________________________________________。
(3)将C通入溴水中,所发生反应的化学方程式是__________;D属于______________晶体(填晶体类型)。
(4)在101 kPa时,4.0 g乙在一定条件下与丙完全反应生成C,放出37 kJ的热量,该反应的热化学方程式是__________________________________________________。
(5)比甲元素的原子序数少4的M元素,在一定条件下能与氢元素组成化合物MH5。已知MH5的结构与氯化铵相似,MH5与水作用有氢气生成,则MH5的电子式为______________(M要用元素符号表示)。写出MH5与AlCl3溶液反应的化学方程式_______________________________________。
44、(2005辽宁模拟)下图表示某化工生产的流程(有的反应条件和产物已略去)
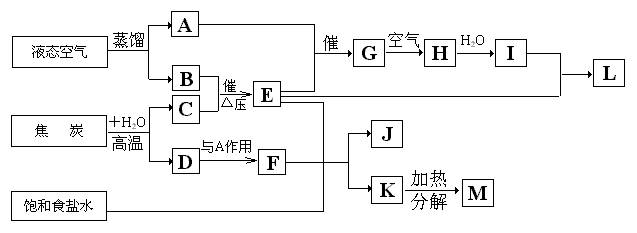 试回答:
(1)、C的分子式是
,L的名称是
。
(2)、写出A与E反应生成G的化学方程式:
(3)、G到H的反应中,氧化剂与还原剂的物质的量之比为
(4)、写出饱和食盐水与F和E反应生成J和K的化学方程式:
(5)、写出由上述流程图中出现的元素组成的五种铵盐的化学式:
试回答:
(1)、C的分子式是
,L的名称是
。
(2)、写出A与E反应生成G的化学方程式:
(3)、G到H的反应中,氧化剂与还原剂的物质的量之比为
(4)、写出饱和食盐水与F和E反应生成J和K的化学方程式:
(5)、写出由上述流程图中出现的元素组成的五种铵盐的化学式: 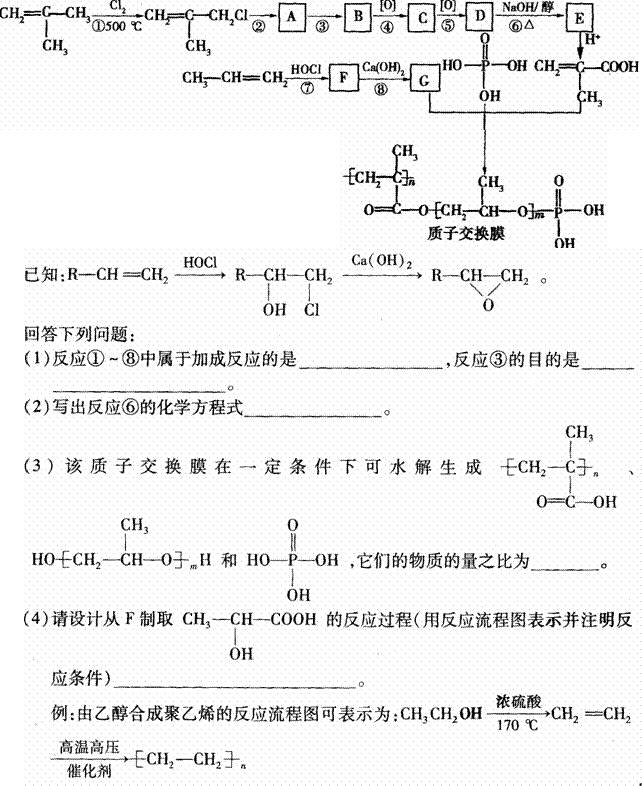
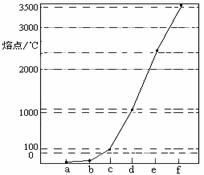 (8分)右图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。
(8分)右图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。 键 和 个
键 和 个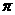 键。
键。
 (3)a与b的元素形成的10电子中性分子X的空间构型为
; 将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到络离子的化学式为
,其中X与Ag+之间以
键结合。
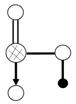
(3)a与b的元素形成的10电子中性分子X的空间构型为
; 将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到络离子的化学式为
,其中X与Ag+之间以
键结合。 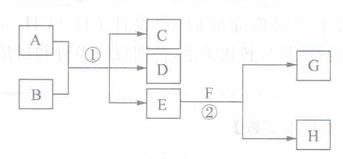 (13分)下图所示物质转化中,常温下E为无色、无味的液体,F为淡黄色粉末,G为无色气体(反应条件均已省略)。
(13分)下图所示物质转化中,常温下E为无色、无味的液体,F为淡黄色粉末,G为无色气体(反应条件均已省略)。
 该氢化物与D的单质在碱性介质中可以形成燃料电池,写出该燃料电池的负极上发生反应的电极反应式____________________。
该氢化物与D的单质在碱性介质中可以形成燃料电池,写出该燃料电池的负极上发生反应的电极反应式____________________。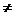 υ逆 的是 ________,
υ逆 的是 ________, (1)我们知道,稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解。该反应的化学方程式为____________________________________。
(1)我们知道,稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解。该反应的化学方程式为____________________________________。