27.(15分)
某白色粉末其成分可能是碳酸钠和亚硫酸钠的一种或两种组成。请完成对该白色粉末成分的探究:
限选实验仪器:药匙、试管、单孔塞、导管、玻璃棒、滴管、带铁夹的铁架台。
限选实验试剂:1 mol·L-1H2SO4、3%H2O2、澄清石灰水、品红试液。
(1)提出合理假设
假设1: ;
假设2: ;
假设3: 。
(2)设计实验方案证明你的假设
(3)实验过程
根据(2)的实验方案,进行实验。请在答题纸上按下表格式写出实验操作步骤、预期现象与结论。
|
实验操作 |
预期现象与结论 |
|
步骤1:检查装置气密性… |
|
|
步骤2: |
|
|
… |
|
化学-化学与技术
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
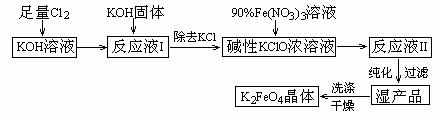
已知:① 2KOH + Cl2 → KCl + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH → 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4具有强氧化性的原因 ;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度为 ;
(5)在“反应液I”中加KOH固体的目的是 :
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
(6)从“反应液II”中分离出K2FeO4后,会有副产品 (写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途 。
化学-物质结构与性质(15分)
(1)在配合物Fe(SCN)2+中,提供空轨道接受孤对电子的微粒是________ _______,画出配合物离子 [Cu(NH3)4]2+中的配位键__________ __________ 。
(2)根据VSEPR模型,H3O+的分子立体结构为___________ ________________,
BCl3的立体结构为___________ _________________。
(3)按要求写出由第二周期元素为中心原子,通过sp3杂化形成中性分子的化学式
(各写一种)
正四面体分子_______,三角锥形分子________,V形分子_________。
化学-有机化学基础(15分)
已知: 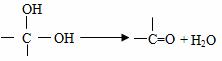
下图中X分子式为C4H2Br2O4,为六元环化合物,核磁共振氢谱表明其分子中只有一种类型H原子的吸收峰。
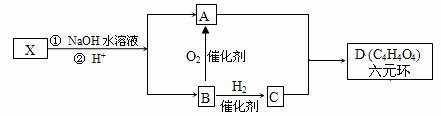
(1)D中所含官能团的名称 。
(2)X的结构简式 。它可以发生 (填字母)
a、取代反应 b、消去反应 c、加成反应
(3)写出A和C按1:1反应生成聚合物的化学方程式。
。
(4)D有多种同分异构体,写出满足以下条件的任意两种同分异构体的结构简式
a、能与NaHCO3溶液反应放出气泡 b、能发生水解反应 c、分子内含有环状结构
、
(5)根据题示信息,用乙炔为主要原料设计合成路线合成HOCH2CHO。
要求:①合成路线用反应流程图表示。
②标明每一步的反应物及反应条件。(有机物写结构简式,其它原料自选)
例:由乙醇合成聚乙烯的反应流程图可表示为
CH3CH2OH浓硫酸170℃CH2=CH2高温、高压催化剂 CH2-CH2
CH2-CH2
_______________________________________________________________________
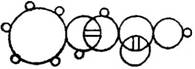 奥地利杰出的化学家约瑟夫·劳施密特在他所著的《化学研究》中有如图所示的物质圆圈图,即肉桂酸(C9H8O2)的分子结构,下列有关肉桂酸的说法中错误的是( )
奥地利杰出的化学家约瑟夫·劳施密特在他所著的《化学研究》中有如图所示的物质圆圈图,即肉桂酸(C9H8O2)的分子结构,下列有关肉桂酸的说法中错误的是( ) -CH=CH-COOH
-CH=CH-COOH 互为同分异构体
互为同分异构体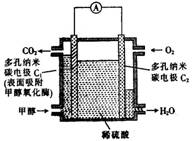 酶生物燃料电池(BFC)是以有机物为燃料,利用酶作催化剂的一种特殊的燃料电池,能量转化效率高,其工作原理如图所示,下列有关说法中不正确的是()
酶生物燃料电池(BFC)是以有机物为燃料,利用酶作催化剂的一种特殊的燃料电池,能量转化效率高,其工作原理如图所示,下列有关说法中不正确的是()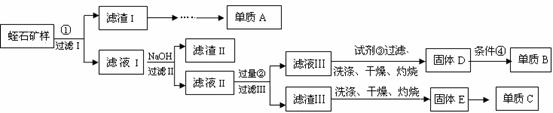
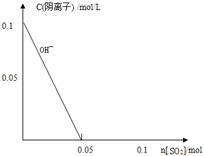 ____________________________________________________________________;
____________________________________________________________________; PCl5(g)达平衡时, PCl5为0.40mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达到平衡PCl5的物质的量是
PCl5(g)达平衡时, PCl5为0.40mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达到平衡PCl5的物质的量是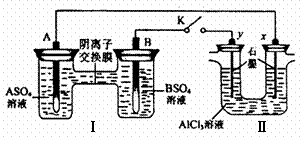 A.0.40mol B.0.20mol C.小于0.20mol D.大于0.20mol,小于0.40mol
A.0.40mol B.0.20mol C.小于0.20mol D.大于0.20mol,小于0.40mol