27.(10分)
不同元素的原子在分子内吸引电子的能力大小可用数值表示,该数值称为电负性。一般认为:如果两个成键元素间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键元素间的电负性差值小于1.7,通常形成共价键。下表是某些元素的电负性值:
|
元素符号 |
Li |
Be |
B |
C |
O |
F |
Na |
Al |
Si |
P |
S |
Cl |
|
电负性值 |
0.98 |
1.57 |
2.04 |
2.55 |
3.44 |
3.98 |
0.93 |
1.61 |
1.90 |
2.19 |
2.58 |
3.16 |
观察上述数据,回答下列问题:
(1)通过分析电负性值变化规律,确定Mg元素电负性值的最小范围 ;
(2)请归纳元素的电负性和金属、非金属的关系是 ;
(3)COCl2俗称光气,分子中C原子以 杂化轨道方式与其它原子成键;分子结构中含有C-Cl键,其共用电子对偏向 (写原子名称)。
(4)氯和硅元素形成的化合物SiCl4为共价化合物,它与氨气一起使用可用于海上军事作战起烟幕作用,试说明原因并写出相应发生的化学反应方程式:
;
(5)从电负性角度,判断AlCl3是离子化合物还是共价化合物?请说出理由(即写出判断的方法和结论)是:
;请设计一个实验方案证明上述所得到的结论:
。
24. (12分)
铜及铜的化合物有多种应用。请回答下面相关问题:
|
|
②Cu+2H2SO4(浓) = CuSO4+SO2↑+2H2O
假如某工厂欲生产CuSO4,请选择一种方法并说明理由 。
(2)已知铜与稀硫酸不反应,但将铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示原因 。
如果铜片在稀硫酸中加热时滴入几滴H2O2, 溶液也会很快呈蓝色,请用离子方程式表示原因 。
(3)已知:2Cu(s)+1/2 O2(g)=Cu2O(s) ;△H1=–12.0kJ/mol
2Cu(s)+S(s) = Cu2S(s) ; △H2 =–79.5kJ/mol
S(s)+ O2 (g) = SO2(g) ; △H3 =–296.83kJ/mol
求 Cu2S(s)+2 Cu2O(s) =6 Cu(s)+ SO2(g) ; △H4 = kJ/mol
(4)某黑色固体据分析由Cu2S和CuS组成。
已知 Cu2S可以和硝酸反应,请配平下列化学反应方程式:
|
化学兴趣小组同学欲分析黑色固体的成分,设计了如下实验方案:先称取样品m1g,然后充分加热反应后测得生成CuO质量为m2g,则样品中含Cu2S g。
23. (11分)
某学校研究性学习小组设计实验探究铝等金属的性质:将一置于空气中的铝片投入浓氯化铜溶液中,铝片表面出现一层海绵状暗红色物质,接下来铝片上产生大量气泡,产生的气体,具有可燃性,溶液温度迅速上升。若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是___ ________。(填序号)
A.铝与Cl-反应,铝与SO42-不反应
B.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
C.硫酸铜水解生成硫酸使铝钝化
D.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
E.生成氯化铝溶于水,而生成硫酸铝不溶于水
(2)铝片表面出现的暗红色物质是 。
(3)放出的气体是________,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是 。
(4)某同学通过其它的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是_ _ __。
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.向硫酸铜溶液中加入氯化钠固体,再投入铝片
(5)除去氧化铝的铝片与镁片为电极,在 X 电解质溶液中构成原电池,列表如下:
|
选项 |
铝电极 |
电解质 |
负极反应 |
正极反应 |
|
A |
负极 |
NaOH |
2Al-6e-+8OH-=2AlO2-+4H2O |
6H2O+6e-=6OH-+3H2↑ |
|
B |
负极 |
稀盐酸 |
2Al-6e- = 2Al3+ |
6H++6e-=3H2↑ |
|
C |
正极 |
浓硝酸 |
Mg + 2e-= Mg2+ |
2NO3-+4H+-4e-=2NO2↑+2H2O |
其中正确的是 (填序号),由此推知,金属作电极不仅与本身性质相关,而且与 有关。
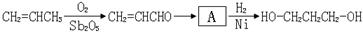
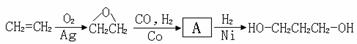 [路线2]环氧乙烷甲酰化法:
[路线2]环氧乙烷甲酰化法: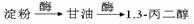
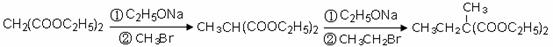
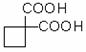
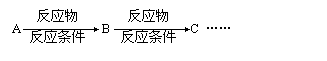 利用该反应原理,以丙二酸二乙酯、1,3-丙二醇、乙醇为原料合成
, 请你设计出合理的反应流程图。提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:
利用该反应原理,以丙二酸二乙酯、1,3-丙二醇、乙醇为原料合成
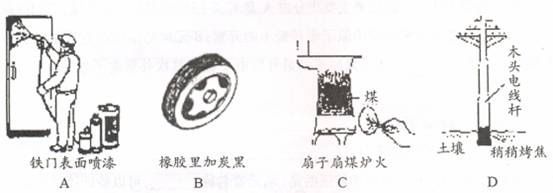
, 请你设计出合理的反应流程图。提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下: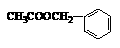 是其中的一种,它可以从茉莉花中提取,也可以乙烯和甲苯为原料进行人工合成。其中一种合成路线如下:
是其中的一种,它可以从茉莉花中提取,也可以乙烯和甲苯为原料进行人工合成。其中一种合成路线如下:
 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3 SiO2(s)+ 6
C(s) + 2 N2(g)
Si3N4(s)+ 6 CO(g)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3 SiO2(s)+ 6
C(s) + 2 N2(g)
Si3N4(s)+ 6 CO(g)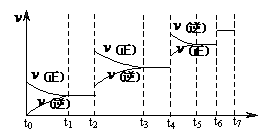 (4)达到平衡后,改变某一外界条件(不改变
(4)达到平衡后,改变某一外界条件(不改变 与时间t的关系如右图。
与时间t的关系如右图。 (16分)
(16分)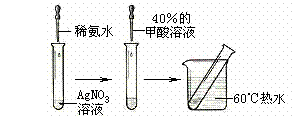 猜想I:甲酸具有酸性;
猜想I:甲酸具有酸性; ②你设计的实验方案是:
②你设计的实验方案是: 实验方案请参考如下形式:
实验方案请参考如下形式: