28.(10分) (1)[Ar]3d64s2 金属 (各1分)
(2) 8 (2分) 12 (2分)
(3)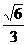 (2分) (4)
(2分) (4) (2分)
(2分)
26B、(汕头二模)(10分)(1)下面是几种物质的溶解度数据:
|
物质 |
熔点(℃) |
溶解度(g/100g苯) |
物质 |
沸点(K) |
20℃1atm时的溶解度(g/100g水) |
 |
216.3 |
1.84 |
H2 |
20.3 |
0.00016 |
 |
100 |
60.7 |
N2 |
77.35 |
0.0019 |
|
Cl2 |
239.1 |
0.72 |
|
溶剂状态 |
溶质状态 |
力的类型 |
力的大小 |
溶解结论 |
|
液态 |
固态 |
相似 |
F溶质>F溶剂 |
有限溶解 |
|
相异 |
难溶 |
|||
|
液态 |
相似 |
F溶质≈F溶剂 |
互溶 |
|
|
相异 |
难溶 |
|||
|
气态 |
相似 |
F溶质<F溶剂 |
有限溶解 |
|
|
相异 |
难溶 |
上述数据可以说明,结构相似的一类固体,在液体中的溶解度的规律是
;
结构相似的一类气体,在液体中的溶解度的规律是
。
固体和气体在液体中的溶解度呈现上述规律的原因是
。
(2)①第四周期元素电子排布的能级能量由低到高依次为4s、3d、4p,第六周期元素电子排布的能级能量由低到高依次为: 。
②若某元素价电子为3d74s2,则该元素位于元素周期表的第 周期, 族,原子序数为 ,其原子的核外电子中成单电子有 个。
26B.(10分)(1)固体的熔点越高,在液体中的溶解度越低,(2分)气体的沸点越高,在液体中的溶解度越高。(2分)当固体(气体)中的分子间的作用力与液体中的分子间的作用力相近时,溶解度最大。(1分)
(2)①6s、4f、5d、6p(1分)②四(1分),Ⅷ(1分),27(1分),3(1分)
27、 (10分)
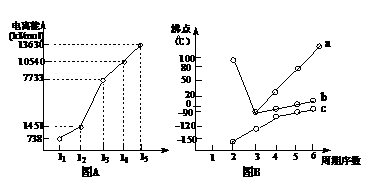 (1)I.短周期某主族元素M的电离能情况如右图(A)所示。则M元素位于周期表的第 族。
(1)I.短周期某主族元素M的电离能情况如右图(A)所示。则M元素位于周期表的第 族。
II.图B折线c可以表达出第 族元素氢化物的沸点的变化规律。两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是: (填“a”或“b”);部分有机物的熔沸点见下表:
|
烃 |
CH4 |
CH3CH3 |
CH3(CH2)2CH3 |
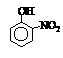
硝基苯酚 |
 |
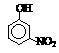 |
 |
|
沸点/℃ |
-164 |
-88.6 |
-0.5 |
熔点/℃ |
45 |
96 |
114 |
由这些数据你能得出的结论是(至少写2条): ,
。
(2)COCl2俗称光气,分子中C原子采取 杂化成键;其中碳氧原子之间共价键含有 (填字母):a.2个σ键;b.2个π键;c.1个σ键、1个π键。
(3)金属是钛(22Ti) 将是继铜、铁、铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布式为 ;
II.已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种晶体的样品配成溶液;b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现:其沉淀质量:绿色晶体为紫色晶体的2/3。则绿色晶体配合物的化学式为 。
22、(肇庆二模)(8分)下表是元素周期表的前三周期,用相应的化学用语回答下列问题:
|
|
|
|
|
|
|
|
|
|
a |
|
|
b |
c |
d |
e |
|
|
f |
|
g |
|
|
|
|
|
(1)g的单质与f元素的最高价氧化物的水化物反应的离子方程式为 。
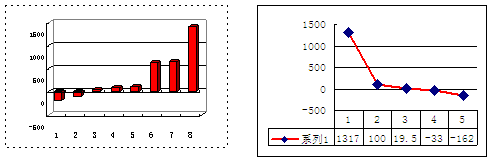

(2)第三周期8种元素按单质熔点(℃)大小顺序的柱形图(上左图),其中横座标:“2”代表 ,“8”代表 。
(3)a、b、c、d、e的氢化物的沸点直角坐标图(上右图),横座标序号“1”氢化物的体类别为 (填编号):①共价化合物、②离子化合物; CH4位于该坐标图中的横座标的序号 ;某燃料电池用CH4作燃料、KOH溶液作电解质,则该燃料电池负极的电极反应为: 。

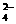 )>c(NH
)>c(NH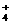 )>c(OH-) (1分) (3)102a-14 (3分)
)>c(OH-) (1分) (3)102a-14 (3分)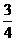 倍,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。请回答下列问题
倍,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。请回答下列问题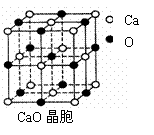 Na2O+Cl2=2NaCl+O2
Na2O+Cl2=2NaCl+O2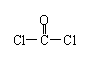 ⑶
(2分) c(2分)
⑶
(2分) c(2分)