7.已知化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶。现有一份甲和乙的混合物样品,通过实验进行分离,可得到固体甲。(实验中使用的过滤器是用于过滤强酸性液体的耐酸过滤器)
请填写表中空格,完成由上述混合物得到固体甲的实验设计。
|
序号 |
实验步骤 |
简述实验操作(不必叙述如何组装实验装置) |
|
① |
溶解 |
将混合物放入烧杯中,加入98%H2SO4,充分搅拌直到固体不再溶解 |
|
② |
  |
|
|
③ |
|
|
|
④ |
|
|
|
⑤ |
洗涤沉淀 |
|
|
⑥ |
检验沉淀 是否洗净 |
|
|
|
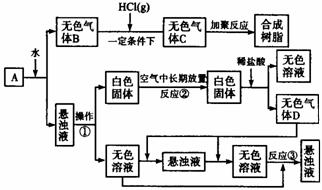
完成下面问题:
(1)在实验室中收集气体B的方法是 。
(2)操作①的名称是 。
在操作①中所使用的玻璃仪器的名称是 。
(3)写出反应②和反应③的化学方程式:
反应② ,
反应③ 。
(4)A的化学式是 。
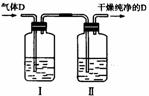
(5)在实验室中,如要获得干燥纯净的气体D,可以将它通过如上图所示的装置,其中瓶I中盛放的试剂是 ,瓶Ⅱ中盛放的试剂是 。
收集干燥气体D的方法是 。
5.晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
|
③SiHCl3与过量H2在l000-1100℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为 。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
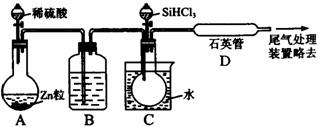
①装置B中的试剂是 。装置C中的烧瓶需要加热,其目的是
。
②反应一段时间后,装置D中观察到的现象是 ,
装置D不能采用普通玻璃管的原因是 ,
装置D中发生反应的化学方程式为 。
③为保证制备纯硅实验的成功,操作的关键是检验实验装置的气密性,控制好反应温度以及 。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是 。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
|
化学实验(一)
1.某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向溶液中滴加稀硫酸至溶液pH=8-9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液蒸发浓缩、冷却、结晶、过滤、干燥。
请回答以下问题:
(1)上述实验中的过滤操作需要玻璃棒、 、 等玻璃仪器。
(2)步骤1过滤的目的是 。
(3)当步骤2中溶液的pH=8-9时,检验沉淀是否完全的方法是
。
(4)简述你认为调节pH=8-9时的简单方法:
。
(5)步骤2中溶液的pH较难控制,可改用 。
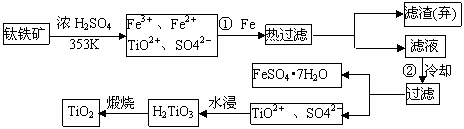
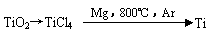 (4)由金红石(TiO2)制取单质Ti,涉及到的步骤为:
(4)由金红石(TiO2)制取单质Ti,涉及到的步骤为: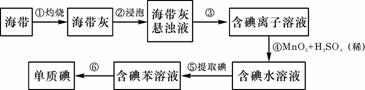
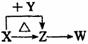 X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有如右图转化关系(部分反应物、产物及反应条件已略去)。
X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有如右图转化关系(部分反应物、产物及反应条件已略去)。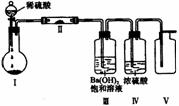 (3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用右图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置V中可收集到一种无色气体。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用右图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置V中可收集到一种无色气体。

 (2)将NH3通入溴水中,有N2生成,反应的化学方程式为
(2)将NH3通入溴水中,有N2生成,反应的化学方程式为
 (1)制备氧化铜
(1)制备氧化铜