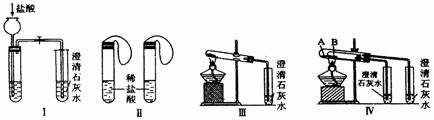
1 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
第二卷(非选择题,55分)
16(14分,每空2分)
(1)________________________ _。
(2)______________________ ___。
(3)__________________ __。
(4)________________ _。
(5)__________________ ___,
____________ _。
_______________ __。
17(15分,每空3分)
(1) ________ (填代号)。
(2) _______ _,
______ _ 。
(3) ②________________________________________________________________________。
③________________________________________________________________________。
|
18(12分,每空3分)
(1) _______________________________ _________;
(2) _______ _g;
(3)
。
(4) (填序号)
19(15分,(1)小问共3分,其余每空3分)
(1)______KIO3+______KI+______H2SO4===______K2SO4+_____I2+_____H2O
(2) ①__________________________ ____。
②____________________________ __。
(3) ①________ 。
②__________________________mg/kg。
19.(18分)某市场销售的某种食用精制盐包装袋上有如下说明:
|
产品标准 |
GB5461 |
|
产品等级 |
一级 |
|
配料 |
食盐、碘酸钾、抗结剂 |
|
碘含量(以Ⅰ计) |
20-50 mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
______KIO3+______KI+______H2SO4===______K2SO4+_____I2+_____H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是_________________________ _____。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是______________________________。
(3)已知:I2+2S2O===2I-+S4O。
某学生测定食用精制盐的碘含量,其步骤为:
a.准确称wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2SO3溶液10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是________。
②根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)__________________________mg/kg。
祁阳四中2010年下学期高三第一次月考化学试题答卷
第一卷 (选择题,45分)