网址:http://m.1010jiajiao.com/timu3_id_424294[举报]
Ⅰ.某学生想自己设计实验方案,以证明样品中确实没有FeO.除样品外,实验室只提供以下试剂:KMnO4溶液、稀盐酸、稀硫酸、KSCN溶液、NaOH溶液和双氧水.你认为要完成该实验所选择的试剂是_________,请你描述实验操作时的步骤、实验现象和结论:_____________________。
Ⅱ.测定混合物中Fe2O3的含量实验室可用多种方法测出上述样品中Fe2O3的质量分数.现有学生准备用题图中各装置按一定顺序连接成一套完整的组合装置来进行实验以测定Fe2O3的质量分数.

(1)装置的连接顺序是_________(填字母,每个装置只能用一次)
(2)实验过程中需要持续通入空气,其作用除可以起到“搅拌”A、D中反应物达到充分反应外,还有一个重要作用是_________________
(3)下列各项措施中,能提高测定准确度的是__________(填标号)
a.在加入盐酸之前,应该排尽装置内的CO2气体
b.快速加入盐酸
c.在B中装入浓硫酸
d.在B中装入NaOH溶液
e.D之后增添盛有饱和碳酸氢钠溶液的洗气装置
(4)实验室准确称取26.0g固体样品装入D中,充分反应后,测得A中沉淀质量为19.7g,则样品中Fe2O3的质量分数为__________
(5)在进行实验方案评价时,有学生认为不必测定A中的沉淀质量,而只要测出装置A在吸收反应产生的气体前后的质量差,就能完成实验要求.实验证明,若用此法测得Fe2O3的质量分数将______(填“偏高”、“偏低”、“不变”)
化学实验中,同一个装置可以用于不同的实验,例如图的实验装置(B中可为固体或液体,可加热)。
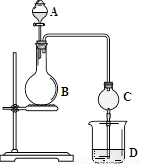
(1)若A中为浓盐酸,B中为高锰酸钾固体,D中为石蕊溶液,则D中现象为________________________。
(2)若A中为足量的浓硝酸,B中为铜单质,D中用NaOH来吸收其产生的气体,请写出D中所发生的反应的化学方程式________________________________________________。
(3)若A中为浓H2SO4,B中为NaCl固体, D中是Na2S与Na2SO3的混合溶液,打开分液漏斗后,加热,D中出现黄色沉淀并有臭鸡蛋气味的气体逸出,则D中n(Na2S)与n(Na2SO3)需满足的条件是______________________________。
(4)该装置可以模拟氨碱法制纯碱,D中为饱和食盐水。先制取________气体通入D中至饱和,再制取_______气体也通入D中,此时可以看到溶液中有晶体析出。请写出该反应的化学方程式___________________________________________________。
(5)利用上述装置,下列实验不可能实现的是_____________________
A.证明碳酸比苯酚的酸性强 B.证明氯气的氧化性比溴强
C.用乙醇制备并检验乙烯 D.制备并收集乙酸乙酯
(6)若A中为稀硫酸,B中为碳酸氢钠固体,打开分液漏斗反应一段时间,D中先无现象,后慢慢产生沉淀且不溶解,则D溶液的原溶质可能是______________________________。
查看习题详情和答案>>
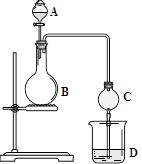
化学实验中,同一个装置可以用于不同的实验,例如图的实验装置(B中可为固体或液体,可加热)。
(1)若A中为浓盐酸,B中为高锰酸钾固体,D中为石蕊溶液,则D中现象为________________________。
(2)若A中为足量的浓硝酸,B中为铜单质,D中用NaOH来吸收其产生的气体,请写出D中所发生的反应的化学方程式________________________________________________。
(3)若A中为浓H2SO4,B中为NaCl固体, D中是Na2S与Na2SO3的混合溶液,打开分液漏斗后,加热,D中出现黄色沉淀并有臭鸡蛋气味的气体逸出,则D中n(Na2S)与n(Na2SO3)需满足的条件是______________________________。
(4)该装置可以模拟氨碱法制纯碱,D中为饱和食盐水。先制取________气体通入D中至饱和,再制取_______气体也通入D中,此时可以看到溶液中有晶体析出。请写出该反应的化学方程式___________________________________________________。
(5)利用上述装置,下列实验不可能实现的是_____________________
| A.证明碳酸比苯酚的酸性强 | B.证明氯气的氧化性比溴强 |
| C.用乙醇制备并检验乙烯 | D.制备并收集乙酸乙酯 |
(1)若A中为浓盐酸,B中为高锰酸钾固体,D中为石蕊溶液,则D中现象为________________________。
(2)若A中为足量的浓硝酸,B中为铜单质,D中用NaOH来吸收其产生的气体,请写出D中所发生的反应的化学方程式________________________________________________。
(3)若A中为浓H2SO4,B中为NaCl固体, D中是Na2S与Na2SO3的混合溶液,打开分液漏斗后,加热,D中出现黄色沉淀并有臭鸡蛋气味的气体逸出,则D中n(Na2S)与n(Na2SO3)需满足的条件是______________________________。
(4)该装置可以模拟氨碱法制纯碱,D中为饱和食盐水。先制取________气体通入D中至饱和,再制取_______气体也通入D中,此时可以看到溶液中有晶体析出。请写出该反应的化学方程式___________________________________________________。
(5)利用上述装置,下列实验不可能实现的是_____________________
| A.证明碳酸比苯酚的酸性强 | B.证明氯气的氧化性比溴强 |
| C.用乙醇制备并检验乙烯 | D.制备并收集乙酸乙酯 |

(1)实验室制取氨气的化学方程式为 ,工业上合成氨采取的下列措施中可用勒夏特列原理解释的是? ?(填字母)?
A.采用较高压强(20 Mpa~50 Mpa)?
B.采用500 ℃的高温?
C.用铁触媒作催化剂?
D.将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2?
(2)适当改变如图所示的装置后,也可用来制取和收集氧气。改变的方法是: 。?
(3)实验室用浓硫酸和铜制取并收集少量的SO2气体,能否采用该装置 ? ?(填“能”或“不能”),若选填“能”,请说明理由;若选填“不能”,则怎样改变该装置后就能达到实验目的?请用文字说明 ;?
(4)取6.4 g铜片和12 mL 18.4 mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,某同学根据所学的化学知识认为还有一定量的硫酸剩余。下列药品能够用来证明反应结束后烧瓶中确实有余酸的是?? ??(填字母)。?
A.铁粉 B.氯化钡溶液? C.银粉 D.碳酸氢钠溶液?
(5)为定量测定余酸物质的量浓度,某同学进行了如下设计:先测定铜片与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度。测定SO2的量的方案很多,下列方案可行的
是 (填字母)?
A.将装置中产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量?
B.将装置中产生的气体缓缓通入足量氢氧化钡溶液,反应完全后过滤、洗涤、干操、称量沉淀?
C.将装置中产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后过滤、洗涤、干燥、称量沉淀?
请对不可行的方案进行分析(可以不填满)
方案序号 | 分析 | 误差(偏高或偏低) |
|
|
|
|
|
|
|
|
|
(6)请再设计其他可行的实验方案来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算)。??
查看习题详情和答案>>